��Ŀ����
����Ŀ��ˮ����һ�㺬 CaCO3��Mg��OH��2�����ܺ��� MgCO3�������������κ����ʣ���ijͬѧȡ�����ᾧˮ��ˮ����Ʒ�����о���������ͼ��������˵����ȷ���ǣ����������Է���������CaCO3 100 Mg��OH��2 58 MgCO3 84����������

A. ��ˮ���������� CO2���� 2.64 g
B. ��ˮ����һ������ CaCO3��Mg��OH��2��һ������ MgCO3
C. ��ˮ����һ������ CaCO3��Mg��OH��2�����ܺ��� MgCO3
D. ��ˮ����һ������ CaCO3��Mg��OH��2�� MgCO3
���𰸡�AD
��������
���������غ㶨�ɡ����ɶ�����̼��������ˮ���������û�ѧ����ʽ���з���������ʱ�ɲ��ü���ķ������м���Աȵó����ۡ�
A���������غ㶨�ɿ�֪����ˮ����������CO2���������Ϊ��5.78g��2.96g��0.18g��2.64g��
����B��C��D�������ˮ���в���̼��þ����̼����ڸ��µ������·ֽ�Ϊ�����ƺͶ�����̼��������þ�ڸ��µ������·ֽ�Ϊ����þ��ˮ������ˮ�������������������þ���������ٽ�һ������������Ƶ����������������Ƶ����������û�ѧ����ʽ�����̼��Ƶ����������ݶ�����̼���������û�ѧ����ʽ�����̼��Ƶ��������Ƚϼ������Ƿ���ȣ�����ͬ����̼��þ��������ȣ���һ������̼��þ��
Ũ�������ص�������Ϊ������þ�ֽ�����ˮ��������������0.18gˮ��ͬʱ��������þ������Ϊx����
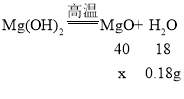
![]()
x��0.4g
�������Ƶ�����Ϊ��2.96g��0.4g��2.56g��
������2.56g��������Ҫ̼��Ƶ�����Ϊy����
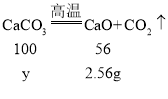
![]()
y��4.57g
������2.56g��������Ҫ̼��Ƶ�����Ϊ4.57g
������2.64g������̼��Ҫ̼��Ƶ�����Ϊz����
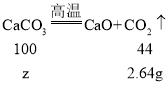
![]()
z��6g
��Ϊ4.57g��6g�����Ը�ˮ����һ������ CaCO3��Mg��OH��2 �� MgCO3��
��ѡ��AD��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�