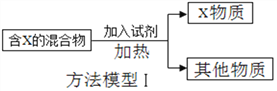
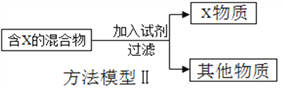
��Ŀ����
����Ŀ��ij�о�С�鰴��ͼ��ʾ���̽�����ȼú�����������о�����ʵ���У�SO2��O2�����������ͨ�룬ˮ��������ʼʱһ���Լ��룬��ӦҺ���ѭ����
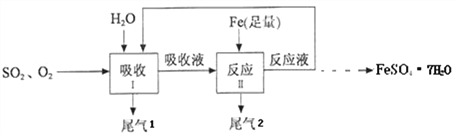
(1)���բ��з�����Ӧ�Ļ�ѧ����ʽ��2SO2+ 2H2O+O2 == 2X����X�Ļ�ѧʽ��________.
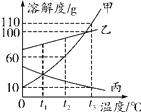
������ˮ����ʱ��Ϊ�����SO2��O2������Ч�ʣ���Ӱ�������ܽ�ȵ����ؿ��ǣ�Ӧ�ÿ����¶Ȳ��˹�________(����������������)
(2)��Ӧ���з����Ļ�ѧ����ʽ��_____________________��
(3)Ϊ��ȷ����ӦҺ��ѭ������Ч��������Һ�����ķ�Ӧ�������40�����ҽ��У��ڴ����������ӿ�÷�Ӧ��������˲�ȡ�Ĵ�ʩ��______________________(ֻҪ��һ��)�����ŷ�ӦҺѭ��������У�����Һ��X�������������Լӿ죬��ԭ�������________________.
(4)�������ѭ���Ժ���ӦҺ�������½ᾧ��_________��ϴ�Ӻ���Ƶ�FeSO4��7H2O���塣����ҽ���ϳ���������______(ѡ����ĸ)��A.��״���״� B.���Ͳ� C.ȣ�� D.ƶѪ֢
���𰸡� H2SO4 �� Fe+H2SO4=FeSO4+H2�� ʹ������(������ʹ�ô���) ���ɵ���������(��Fe2+)��������������������ķ�Ӧ������� ���� D
��������(1)��ӦǰS:2��O:8��H:4����Ӧ��һ��X���ӵ����Ϊ2����ԭ�ӡ�1����ԭ�ӡ�4����ԭ�����ʻ�ѧʽΪ��H2SO4���¶�Խ����������ܽ��ԽС������I����ˮ����ʱΪ�����SO2��O2������Ч�����¶Ȳ��˹�����(2)�������ᷴӦ��������������������д����ѧ����ʽΪ��Fe+H2SO4=FeSO4+H2����(3)Ϊȷ����ӦҺ��ѭ������Ч��������Һ�����ķ�Ӧ�������40�����ҽ������ڴ������¿���ʹ������(������ʹ�ô���)���ӿ�÷�Ӧ����������Һ��X�������������Լӿ�����ԭ����������ɵ���������(��Fe2+)��������������������ķ�Ӧ���������(4)����Һ�з�������������ù��˵ķ�����FeSO47H2O�к���Ԫ�أ�������ƶѪ֢����A���Ԫ���йأ�B���Ԫ���йأ�C���Ԫ���й���

 ����ѧ��ţ��Ӣ��ϵ�д�
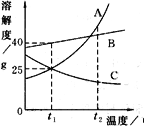
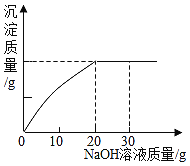
����ѧ��ţ��Ӣ��ϵ�д�����Ŀ���±�Ϊ�Ȼ�狀��Ȼ����ڲ�ͬ�¶�ʱ���ܽ�ȡ�����˵����ȷ����(����)
�¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl �ܽ��/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl �ܽ��/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
A. 20 �棬�Ȼ��Ʊ�����Һ��������������Ϊ36%
B. �ɱ������ݿ�֪���ܽ�����¶ȱ仯Ӱ��ϴ���������Ȼ���
C. �Ȼ������Ȼ���ܽ����ȵ��¶���10 �桫20 ��֮��
D. 50 ��ʱ��100 gˮ�м���50.0 g�Ȼ�������Һ������ȴ��20 �棬�ܹ�����13.2 g����