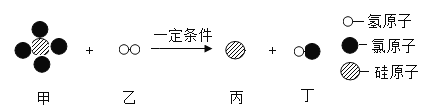
题目内容
【题目】向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,溶液质量与加人锌的质量关系如图所示。请回答下列问题:
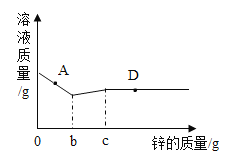
(1)写出A点所发生反应的化学方程式_____。
(2)D点对应的溶液中的金属离子有哪些?_____
(3)当加入锌的质量在bg-c g时,溶液的质量为什么会增加?_____
【答案】![]() Zn2+、Al3+ 锌和硝酸铜发生反应,
Zn2+、Al3+ 锌和硝酸铜发生反应,![]() ,溶液中的溶质由Cu(NO3)2变为Zn(NO3)2,溶液质量增加
,溶液中的溶质由Cu(NO3)2变为Zn(NO3)2,溶液质量增加
【解析】
向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,根据金属活动性顺序,活动性较强的金属能够把活动性较弱的金属从它们的溶液中置换出来。所以,加入一定量锌以后,发生的反应是,锌先与硝酸银反应,如果锌还有剩余,锌再与硝酸铜反应,但锌不与硝酸铝反应,因为铝的活动性比锌的强。
(1)A点处在溶液质量不断减少的曲线上,说明锌正在与硝酸银反应,硝酸银溶液不断转化为硝酸锌,溶液质量不断减少,所以发生反应的化学方程式![]() 。
。
(2)D点处在平行曲线,说明溶液质量不再增加或减少,反应停止,所以对应的溶液中有硝酸锌和硝酸铝,金属离子有Zn2+、Al3+。
(3)当加入锌的质量在bg-c g时, 锌和硝酸铜发生反应, ![]() ,溶液中的溶质由Cu(NO3)2变为Zn(NO3)2,溶液质量增加。
,溶液中的溶质由Cu(NO3)2变为Zn(NO3)2,溶液质量增加。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】人们的生产、生活与化学密不可分。
(1)可用来生产触摸屏的主要原料是氧化铟(In2O3),氧化铟中铟(In)的化合价为_____。
(2)防雾霾口罩透气空隙小,可以把直径较大的颗粒物阻挡在外,其原理与_____(填化学操作名称)类似。
(3)“自热火锅”主要由料包和发热包(主要成分为生石灰、焙烧硅藻土、活性炭等)组成,发热包发热的一种原理是生石灰与水反应。化学方程式可表示为_____。烧硅藻土、活性炭都有_____的结构,能起到吸附作用。
(4)下表是我国颁布的生活饮用水水质标准的部分内容。
项目 | 标 准 |
感官指标 | 无异味、异臭等 |
化学指标 | 铜<1.0mgL,铁<0.3mgL,氟化物<1.0mgL,游离氯≥0.3mgL等 |
感官指标表现的是自来水的_____(填“物理性质”或“化学性质”);化学指标中的铜、铁是指_____(填“元素”或“单质”)。自来水中因含有较多的Ca2+和镁离子_____(填离子符号)被称为硬水。