题目内容
将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50mL12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)( )
分析:依据化学方程式判断氯化氢和二氧化锰反应定量关系分析,MnO2+4HCl
MnCl2+Cl2↑+H2O,浓盐酸随浓度变稀后不能和二氧化锰发生反应.
| ||
解答:解:n(MnO2)=0.15mol,依据化学方程式 MnO2+4HCl
MnCl2+Cl2↑+H2O,二氧化锰全部反应生成氯气物质的量为0.15mol;
将50mL12mol/L的浓盐酸与足量的MnO2反应,n(HCl)=0.05L×12mol?L-1=0.6mol,依据化学方程式 MnO2+4HCl
MnCl2+Cl2↑+H2O,当0.6molHCl完全反应时可生成0.15molCl2,但随着反应的进行,盐酸的浓度逐渐降低,稀盐酸的还原性较弱,与二氧化锰不反应,则生成的氯气的物质的量小于0.15mol,所以前者生成氯气较多.
故选C.
| ||
将50mL12mol/L的浓盐酸与足量的MnO2反应,n(HCl)=0.05L×12mol?L-1=0.6mol,依据化学方程式 MnO2+4HCl
| ||
故选C.
点评:本题考查氯气的实验室制备,题目难度不大,注意稀盐酸与二氧化锰不反应,为解答该题的关键之处.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
电解水时,加入少量氢氧化钠可以增强水的导电性.现将0.1%的氢氧化钠溶液50g通电一段时间后测得此时NaOH溶液的质量分数为0.2%,下列说法正确的是( )
| A、溶液中氧元素质量分数减少 | B、该过程中水分解的质量为25g | C、溶液中阴阳离子的数目增加 | D、溶液减少的体积就是产生气体的体积 |
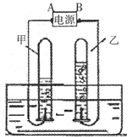 根据下图回答下列问题:
根据下图回答下列问题: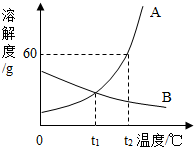 如图是A、B两种固体物质的溶解度曲线.
如图是A、B两种固体物质的溶解度曲线.