题目内容
质量相同的下列四种物质,完全分解后制得氧气最多的是( )
A、H2O2 B、KMnO4 C、KClO3 D、H2O
【答案】
D
【解析】
试题分析:KClO3和H2O中的氧元素全部转化为氧气,可通过比较相同质量的氧元素,物质质量越少的,在物质质量相同的情况下,则生成的氧气越多,故化学式可改为:KClO3和H6O3,很显然,是水分解产生的氧气多.再比较水和双氧水,双氧水中有一半的氧元素转化为氧气,故H2O2和H2O分子个数一样多时,放出的氧气质量相等,由分子可以看出,当质量相等时,水放出的氧气质量最多.
故选D
考点:根据化学反应方程式的计算.

练习册系列答案
相关题目
将一定质量的A、B、C、D四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
下列说法中错误的是( )
下列说法中错误的是( )
| 物质 | A | B | C | D |
| 反应前质量(g) | 16 | 8 | 10 | 5 |
| 反应后质量(g) | 待测 | 3 | 25 | 5 |
| A、A和B是反应物,D可能是催化剂 |
| B、若A与B的相对分子质量之比为2:1,则反应中A与B的化学计量数之比为2:1 |
| C、反应后A物质的质量为6g |
| D、C物质中元素的种类,一定与A、B两种物质中元素的种类相同 |
在一个密闭的容器里有M、N、P、Q四种物质,在一定条件下可发生化学反应,测得反应前后各物质的质量记录如下表,下列说法错误的是( )
|
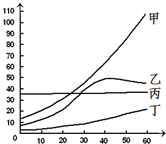 结合表列出几种物质在不同温度时的溶解度回答以下问题.
结合表列出几种物质在不同温度时的溶解度回答以下问题.| 温度/℃ | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
| 溶解度/g | 高锰酸钾 | 2.8 | 4.3 | 6.4 | 9.0 | 12.6 | 18.0 | 22.1 |
| 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.5 | 49.0 | 48.0 | 45.0 | |
| 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
| 硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
(2)表中氯化钠和硝酸钾具有相同溶解度的温度范围是
(3)从溶液中得到晶体主要有以下两种方法.若从硝酸钾的饱和溶液中得到晶体,最常用的方法为
A.蒸发溶剂 B.冷却热的饱和溶液
(4)在通常状况下,下列四种物质中属于易溶物的是
A.高锰酸钾 B.碳酸钠
C.氯化钠 D.硝酸钾
(5)如图所示溶解度曲线中,表示碳酸钠溶解度随温度变化的曲线为
A.甲 B.乙 C.丙 D.丁
(6)60℃时,配制等质量的上述四种溶质的饱和溶液,需要溶质质量最少的是
A.高锰酸钾 B.碳酸钠
C.氯化钠 D.硝酸钾.
 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.
