题目内容
19、许多无明显现象的化学反应可通过滴加其它试剂的方法,使之产生明显的现象以证明反应确实发生了.例如以下几个实验: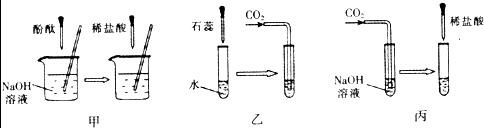
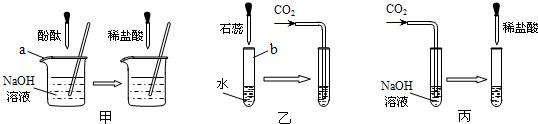
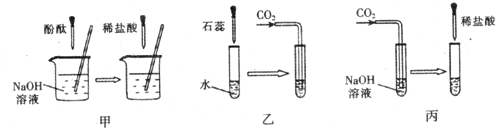
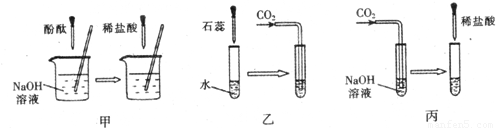
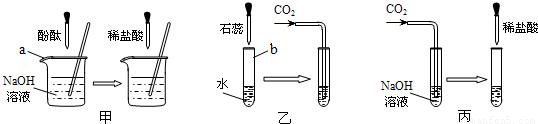
(1)实验甲中的NaOH与HCl恰好反应时,可观察到的现象是
(2)从研究原理得知,实验甲是通过检验反应前后溶液酸碱性的改变证明反应发生了,与之采用相同原理的还有实验
(3)证明实验丙中NaOH与CO2发生了反应,除了可以滴加酸,还可滴加的试剂是
(4)若将含有盐酸的氯化钙溶液中和到中性,在不用指示剂的情况下,加入的试剂可以是

(1)实验甲中的NaOH与HCl恰好反应时,可观察到的现象是
溶液颜色由红色变为无色
;(2)从研究原理得知,实验甲是通过检验反应前后溶液酸碱性的改变证明反应发生了,与之采用相同原理的还有实验
乙
(填“乙”或“丙”);(3)证明实验丙中NaOH与CO2发生了反应,除了可以滴加酸,还可滴加的试剂是
Ca(OH)2溶液
.发生反应的化学方程式为Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
.(4)若将含有盐酸的氯化钙溶液中和到中性,在不用指示剂的情况下,加入的试剂可以是
CaCO3
(写化学式),反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑
.分析:酚酞试液在碱性溶液中为红色,在中性溶液中为无色,实验甲是通过指示剂颜色的变化来判断反应的进行,与之原理相同的是乙,氢氧化钠与二氧化碳反应生成了碳酸钠,检验碳酸盐的存在可以使用加酸的方法,也可以使用加入可溶性钙或钡的化合物反应生成沉淀的方法,要除去氯化钙中的盐酸,可以使用加入碳酸钙的方法.
解答:解:(1)氢氧化钠为碱性溶液,能使酚酞试液变红,当与盐酸恰好反应时,溶液呈中性,酚酞试液在中性溶液中问无色,所以本题答案为:溶液颜色由红色变为无色;
(2)实验甲是通过指示剂颜色的变化来判断反应的进行,与之原理相同的是乙,所以本题答案为:乙;
(3)氢氧化钠与二氧化碳反应生成了碳酸钠,检验碳酸盐的存在可以使用加酸的方法,也可以使用加入可溶性钙或钡的化合物反应生成沉淀的方法,所以本题答案为:Ca(OH)2溶液,Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;
(4)要除去氯化钙中的盐酸,在不用指示剂的情况下,加入的物质与盐酸反应时应该有明显的现象且不能生成新的杂质,因此可以使用加入碳酸钙的方法,所以本题答案为:
CaCO3,CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)实验甲是通过指示剂颜色的变化来判断反应的进行,与之原理相同的是乙,所以本题答案为:乙;
(3)氢氧化钠与二氧化碳反应生成了碳酸钠,检验碳酸盐的存在可以使用加酸的方法,也可以使用加入可溶性钙或钡的化合物反应生成沉淀的方法,所以本题答案为:Ca(OH)2溶液,Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;
(4)要除去氯化钙中的盐酸,在不用指示剂的情况下,加入的物质与盐酸反应时应该有明显的现象且不能生成新的杂质,因此可以使用加入碳酸钙的方法,所以本题答案为:
CaCO3,CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评:本题考查了常见的酸碱盐之间的反应,以及物质的检验和除杂的知识,完成此题,可以依据已有的知识进行,要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目