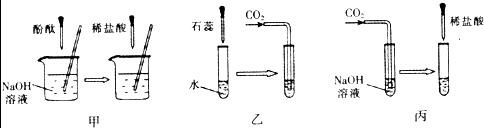
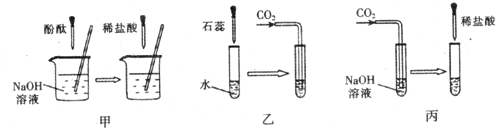
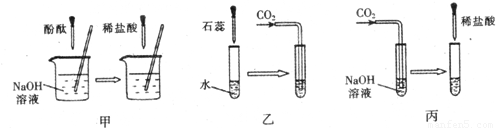
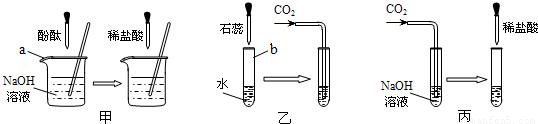
题目内容
许多无明显现象的化学反应可通过滴加其它试剂的方法,使之产生明显的现象以证明反应确实发生了.例如以下三个实验: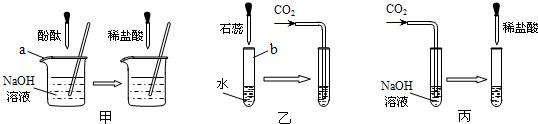
(1)仪器a、b的名称是:a
(2)实验甲中的NaOH与HCl恰好反应时,可观察到的现象是
(3)从研究原理得知,实验甲是通过检验反应前后溶液酸碱性的改变证明反应发生了,与之采用相同原理的还有实验
(4)证明实验丙中NaOH与CO2发生了反应,除了可以滴加酸,还可滴加的另一种试剂是
(5)将0.1molCO2通入含0.2molNaOH的溶液中,恰好完全反应.
①反应生成碳酸钠的物质的量为多少?
②若该反应消耗NaOH溶液的质量为100g,则该NaOH溶液的溶质质量分数为
分析:(1)依据实验室常用仪器的认识解决此题.
(2)根据指示剂的变色规律以及基本反映类型的认识解题.
(3)根据试验中反应中发生的反应以及指示剂的使用规律解题.
(4)根据碳酸盐的性质解题.
(5)根据化学方程式中系数之比等于反应的物质的量之比以及质量分数的概念解题.
(2)根据指示剂的变色规律以及基本反映类型的认识解题.
(3)根据试验中反应中发生的反应以及指示剂的使用规律解题.
(4)根据碳酸盐的性质解题.
(5)根据化学方程式中系数之比等于反应的物质的量之比以及质量分数的概念解题.
解答:解:(1)依据实验室常用仪器的认识解决此题,答案为:烧杯、试管.
(2)恰好反应是溶液为中性,酚酞指示剂在酸性溶液中呈红色而在中性溶液中呈无色;根据四种基本反应类型的概念可知此反应为复分解反应.
故答案为:红色液体变为无色,复分解.
(3)乙中二氧化碳溶于水显酸性,石蕊指示剂显示溶液酸碱性的变化以判断反应是否进行;丙中是以是否放出气体来判断反应是否进行的.故答案为:乙.
(4)氢氧化钠和二氧化碳反应生成碳酸钠:2NaOH+CO2=Na2CO3+H2O,碳酸钠可以和氢氧化钙或氢氧化钡反应生成沉淀:2NaOH+CO2=Na2CO3↓+H2O,所以可以加Ca(OH)2溶液(或Ba(OH)2)以是否生成沉淀来判断反应是否进行.故答案为:Ca(OH)2溶液(或Ba(OH)2).
(5)①解:设生成碳酸钠xmol
CO2+2NaOH═Na2CO3+H2O
1mol 1mol
=
x=0.1mol(答略)
②解:氢氧化钠的物质的量为0.2mol,摩尔质量为40g/mol,
由m=n×M得
氢氧化钠的质量m=0.2mol×40g/mol=8g
质量分数为w(NaOH)=8g/100g=8%
故答案为:8%.
(2)恰好反应是溶液为中性,酚酞指示剂在酸性溶液中呈红色而在中性溶液中呈无色;根据四种基本反应类型的概念可知此反应为复分解反应.
故答案为:红色液体变为无色,复分解.
(3)乙中二氧化碳溶于水显酸性,石蕊指示剂显示溶液酸碱性的变化以判断反应是否进行;丙中是以是否放出气体来判断反应是否进行的.故答案为:乙.
(4)氢氧化钠和二氧化碳反应生成碳酸钠:2NaOH+CO2=Na2CO3+H2O,碳酸钠可以和氢氧化钙或氢氧化钡反应生成沉淀:2NaOH+CO2=Na2CO3↓+H2O,所以可以加Ca(OH)2溶液(或Ba(OH)2)以是否生成沉淀来判断反应是否进行.故答案为:Ca(OH)2溶液(或Ba(OH)2).
(5)①解:设生成碳酸钠xmol
CO2+2NaOH═Na2CO3+H2O
1mol 1mol
| 1 |
| 0.1 |
| 1 |
| x |
x=0.1mol(答略)
②解:氢氧化钠的物质的量为0.2mol,摩尔质量为40g/mol,
由m=n×M得
氢氧化钠的质量m=0.2mol×40g/mol=8g
质量分数为w(NaOH)=8g/100g=8%
故答案为:8%.
点评:酸碱指示剂的变色规律一定要记清楚.计算时注意反应的物质的量之比等于反应方程式的系数之比.

练习册系列答案
相关题目