题目内容
【题目】小林同学在做探究质量守恒定律实验时,称取2.4g镁条在点燃的条件下与充足的空气反应,其反应的化学方程式为 .实验完毕后,称得所得固体的质量小于4.0g.
(提出问题)固体质量为什么会小于4.0g呢?是否发生了其他反应呢?
(查阅资料)镁在空气中燃烧时,除了镁与氧气反应外,还可发生反应:
①2Mg+CO2![]() C+2MgO ②3Mg+N2
C+2MgO ②3Mg+N2![]() Mg3N2
Mg3N2
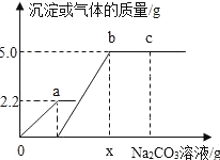
(猜想与假设)反应后固体质量小于4.0g是由于发生反应 (填“①”或“②”)造成的,其理由是 .
(实验探究)根据初中化学所学知识用图所示装置除去空气中的氧气得到氮气(含少量稀有气体).可燃物应选择的物质是 (填写物质的字母代号).
A.木炭 B.红磷 C.硫粉
选择的理由是 .
将点燃的镁条伸入所制得的氮气中,镁条在氮气中剧烈燃烧.
(实验结论)2.4g镁在空气中完全反应后所得固体质量小于4.0g,是由于生成的产物是 的混合物所致.
(评价与反思)通过上述实验,小林对燃烧有了新的认识: .
【答案】2Mg+O2![]() 2MgO;
2MgO;
【猜想与假设】②;根据化学反方程式可知,2.4克镁与氧气反应产生MgO为4.0克、与二氧化碳反应产生4.0克的氧化镁和0.6克的碳;而2.4克镁与纯氮气反应产生Mg3N2为3.33克,且空气中氮气的含量大,因此比反应前的固体质量减轻;
【实验探究】B;红磷只和氧气反应且不产生新的气体;
【实验结论】氧化镁和氮化镁;
【评价与反思】燃烧不一定需要氧气(或氮气也能够支持燃烧等).
【解析】
试题镁和氧气在点燃的条件下产生氧化镁,反应的方程式为:2Mg+O2![]() 2MgO;
2MgO;
【猜想与假设】根据化学反方程式可知,2.4克镁与氧气反应产生MgO为4.0克、与二氧化碳反应产生4.0克的氧化镁和0.6克的碳;而2.4克镁与纯氮气反应产生Mg3N2为3.33克,且空气中氮气的含量大,因此比反应前的固体质量减轻,故反应后固体质量小于4.0g是由于发生反应②造成的;
【实验探究】测定空气中氧气含量的原理:只和氧气反应而不产生新的气体分析选择;而木炭和硫粉都和氧气反应产生新的气体,故选择红磷;
【实验结论】根据化学反方程式可知,2.4克镁与氧气反应产生MgO为4.0克,而2.4克镁与纯氮气反应产生Mg3N2为3.33克,且空气中氮气的含量大,因此比反应前的固体质量减轻的原因是产生氧化镁和氮化镁的混合物的缘故;
【评价与反思】由镁条能在氮气、二氧化碳中燃烧,可知燃烧不一定要有氧气参加或氮气、二氧化碳在一定的条件下也能够支持燃烧等.

 名校课堂系列答案
名校课堂系列答案【题目】我国自主设计的大型客机成功试飞,国产航母下水,标志着我国的金属材料制造技术取得重大突破。根据所学知识回答下列问题:
金属 | A | B | C | D |
导电性(以100为标准) | 99 | 61 | 17 | 7.9 |
密度/(g﹒cm-3) | 8.92 | 2.70 | 7.86 | 11.3 |
熔点/°C | 1083 | 660 | 1535 | 327 |
硬度(以10为标准) | 3 | 2.7 | 5 | 1.5 |
(1)常温下一些金属的物理性质数据如表,据此可知高压输电线最好选用金属_____(填字母);C的合金通常可以做菜刀、锤子等,其合金的硬度_____5(填“>”“<”或“=”)。
(2)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等,写出磁铁矿的主要成分与一氧化碳反应的化学方程式_____。
(3)某兴趣小组为探究Zn、Fe、Cu、Ag四种金属的活动性,进行如下图中甲、乙、丙三个实验。
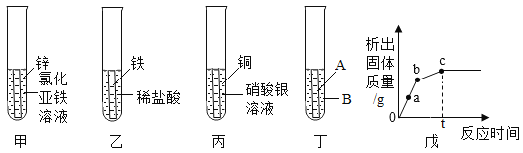
①小组同学随后发现该实验无法得出四种金属的活动性顺序。于是补充图丁实验,最终得出四种金属活动性:Zn>Fe>Cu>Ag,则图丁中的试剂A、B分别为_____(写出一组即可)。
③小组同学将丙试管中的物质过滤后、向滤液中加入甲中剩余的锌,析出固体质量的变化随反应时间的关系如戊图所示。写出a点对应溶液中所含的溶质是_____(填化学式)。