题目内容
【题目】加热分解31.6g高锰酸钾制取氧气。
(1)31.6g高锰酸钾完全分解,可以得到多少克氧气_____?
(2)加热一段时间后,冷却至室温,测得产生的氧气质量占原固体中氧元素质量25%.通过计算,分析说明加热一段时间后得到的固体组成情况_____。
【答案】3.2g 加热一段时间后,冷却至室温,测得产生的氧气质量占原固体中氧元素质量25%. 说明加热一段时间后得到的固体组成为锰酸钾和二氧化锰。
【解析】
根据高锰酸钾的质量和对应的化学方程式求算生成的氧气的质量,然后结合氧气的质量分数以及氧元素在高锰酸钾中的质量分数分析高锰酸钾是否完全反应。
解:(1)设31.6g高锰酸钾完全反应生成的氧气的质量为x,
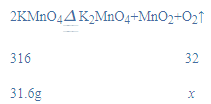
![]()
x=3.2g;
(2)根据化学方程式可以看出,完全分解时生成的氧气的质量占原固体中氧元素的![]() ×100%,而测得产生的氧气质量占原固体中氧元素质量25%,说明高锰酸钾 全反应,所以剩余固体为 锰酸钾、二氧化锰;
×100%,而测得产生的氧气质量占原固体中氧元素质量25%,说明高锰酸钾 全反应,所以剩余固体为 锰酸钾、二氧化锰;
答:(1)31.6g高锰酸钾完全分解,可以得到3.2g;
(2)加热一段时间后,冷却至室温,测得产生的氧气质量占原固体中氧元素质量25%;说明加热一段时间后得到的固体组成为锰酸钾和二氧化锰。

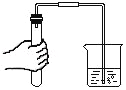
【题目】学小组用如图所示自制装置进行“人体吸入和呼出气体成分”的探究。
(提出假设)人体呼出气体中二氧化碳的含量高于吸入气体。
(实验活动1)
装置 | 实验操作 | 现象 |
| ①在饮料瓶中装水至没过长吸管底端,对着短吸管缓慢吹气 | 水从长吸管端快速流出 |
②将饮料瓶中装满水,对着短管吹气,用排水法收集呼出气体,将燃着的木条快速伸入饮料瓶中 | 饮料瓶中木条熄灭 | |
③将水倒掉,向饮料瓶中加入澄清石灰水至没过长吸管底,从短吸管端吸气30秒,观察石灰水的变化;再从长吸管端吹气30秒,观察石灰水的变化 |
(1)步骤①说明,自制装置的气密性_____(填“良好”或“不好”)。
(2)步骤②中的现象_____(填“能”或“不能”)证明呼出气体中含二氧化碳,原因是_____。
(3)若假设成立,步骤③中,预期会观察到的现象是_____。发生反应的化学方程式为_____。
(实验活动2)实验1中有同学发现,吹气一段时间后发现,浑浊的石灰水重新变得澄清,他用上述装置加入与实验1等体积的石灰水,做下列实验来研究这一问题。
实验编号 | 石灰水浓度 | 持续吹气时间 | 瓶底现象 |
④ | 0.16% | 30秒 | 澄清石灰水变浑浊 |
⑤ | 0.16% | 2分钟 | 澄清石灰水先变浑浊,后又变得澄清 |
⑥ | 0.08% | 30秒 | 澄清石灰水先变浑浊,后又变得澄清 |
⑦ | 0.08% | 2分钟 | 澄清石灰水先变浑浊,后又变得澄清 |
(反思与评价)
(4)能说明石灰水重新变澄清与石灰水浓度有关的实验是_____(填实验编号)。
(5)实验1中,吹气时间均为30秒,有同学观察到石灰水变澄清,而有的学生未观察到产生现象差异的可能原因是_____。