题目内容
【题目】元素X、Y、Z、M是初中常见的四种元素。有关信息如下表:
元素 | 相关信息 |
X | 可形成相对分子质量最小的气体单质 |
Y | 形成的一种单质是天然存在的最硬的物质 |
Z | 其单质约占空气总体积的1/5 |
M | 人体内含量最高的金属元素 |
⑴M元素的名称是_________。
⑵Y形成的天然存在的最硬的物质是_____,此物质不属于_______(填“有机物”或“无机物”)
⑶由X、Y两种元素组成的最简单的有机物是_______(填化学式),该有机物中X元素的质量分数为____________。
⑷由Z、M两种元素按原子个数比1︰1组成的化合物,俗称________,写出它与盐酸反应的化学方程式___________________________。
【答案】 Ca 金刚石 有机物 CH4 25% 生石灰 CaO+2HCl==CaCl2+H2O
【解析】元素X、Y、Z、M是初中化学常见的四种元素,X可形成相对分子质量最小的气体单质,所以X是氢元素,Y形成的一种单质是天然存在的最硬的物质,所以Y是碳元素,Z其单质约占空气体积的![]() ,所以Z是氧元素,M是人体内含量最高的金属元素,所以M是钙元素,经过验证,推导正确:(1)根据分析,所以M是钙元素;(2)碳元素形成的天然存在的最硬的物质是金刚石,此物质不属于有机物;(3)由碳元素、氢元素组成的最简单的有机物是CH4,该有机物中X元素的质量分数为:
,所以Z是氧元素,M是人体内含量最高的金属元素,所以M是钙元素,经过验证,推导正确:(1)根据分析,所以M是钙元素;(2)碳元素形成的天然存在的最硬的物质是金刚石,此物质不属于有机物;(3)由碳元素、氢元素组成的最简单的有机物是CH4,该有机物中X元素的质量分数为:![]() ×100%=25%;(4)由钙、氧两元素按原子个数比1:1组成的化合物,俗称生石灰,氧化钙与盐酸反应生成氯化钙和水,化学方程式为:CaO+2HCl=CaCl2+H2O。
×100%=25%;(4)由钙、氧两元素按原子个数比1:1组成的化合物,俗称生石灰,氧化钙与盐酸反应生成氯化钙和水,化学方程式为:CaO+2HCl=CaCl2+H2O。

 名校课堂系列答案
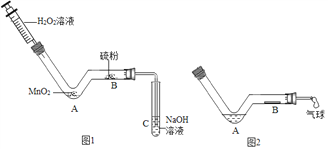
名校课堂系列答案【题目】碱石灰是CaO和NaOH固体的混合物,常用作干燥剂。碱石灰在空气中久置会吸收空气中的水和二氧化碳而变质。某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程。请你参与探究过程:

【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;②CaCl2溶液呈中性。
(1)在操作一实验过程中,同学们发现向样品中加水时放出大量的热。据此实验,下列对样品成分分析正确的是________(填序号)。
A. 一定有NaOH B. 一定有Na2CO3 C. 一定有CaO D. 至少有NaOH、CaO中的一种
(2)在操作二之后所得的固体A中一定含有________。
(3)实验小组的同学继续对溶液B中的溶质进行了探究。
【猜想假设】猜想一:NaOH 猜想二:Na2CO3
猜想三:NaOH和Na2CO3 猜想四:Ca(OH)2和________
【实验验证】为进一步确认溶液B中溶质的成分,做了如下实验。
实验步骤 | 实验现象 | 实验结论 |
①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,用pH试纸检测滤液的pH | ①__________________; ②pH>7 | 猜想三正确 |
实验步骤①中发生的化学反应方程式是________________________________,其实验目的是________________________________。
【反思评价】对于像碱石灰这样容易变质的物质,保存时需要注意密封保存。