题目内容
盐碱湖中捞出来的纯碱中含有一定量的食盐,为测定其中碳酸钠的含量,化学小组的同学将某纯碱样品24.6g放入烧杯中,逐滴加入150g稀盐酸,恰好完全反应,待不再产生气泡时,得到168g的食盐溶液.计算原混合物中碳酸钠的质量分数和反应后溶液的溶质质量分数(CO2的溶解忽略不计).
15.7%
试题分析:依据质量守恒定律可知生成的二氧化碳质量是24.6g+150g﹣168g=6.6g
设:原混合物中碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 6.6g
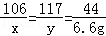
x=15.9g y=17.6g
则样品中碳酸钠的质量分数为=
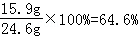
反应后溶液的溶质质量分数为=
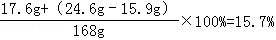
答:原混合物中碳酸钠的质量分数为64.6g;反应后溶液的溶质质量分数(CO2的溶解忽略不计)为15.7%;

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目


