题目内容
已知化肥硝酸铵的含氮量≥34.0%为合格产品.为了检验某化肥厂生产的硝酸铵化肥是否合格,现进行实验:取5.0g样品溶于水,加入足量浓氢氧化钠溶液,充分反应后,测得共放出0.85g氨气.(已知NH4NO3+NaOH=NaNO3+NH3↑+H2O)(1)硝酸铵等铵态氮肥使用时应注意______.
(2)通过计算判断该产品是否合格.
【答案】分析:(1)由题意知铵态氮肥遇碱性物质容易放出氨气,据此分析解答;
(2)利用放出氨气的质量依据方程式对硝酸铵的质量进行计算,即可得计算出硝酸铵的质量分数,而后利用硝酸铵的含氮量即可计算出该样品的含氮量,进而可以判断该产品是否合格;
解答:解:(1)由题意知铵态氮肥与碱能够放出氨气,所以铵态氮肥不能与碱性肥料混合使用,以免降低肥效;
(2)设5g样品中硝酸铵的质量是x
NH4NO3+NaOH=NaNO3+NH3↑+H2O
80 17
x 0.85g
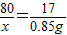
x=4g
所以样品中硝酸铵的质量分数为 ×100%=80%
×100%=80%
硝酸铵的含氮量是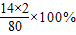 =35%
=35%
所以样品中氮元素的质量分数为35%×80%=28%<34.0%
故该化肥不合格;
故答案为:(1)不能与碱性肥料混合使用;(2)该化肥不合格;
点评:本题主要考查了化合物中某元素的质量分数和物质的纯度的有关知识,属于化学方程式与化学式计算的综合考查题;
(2)利用放出氨气的质量依据方程式对硝酸铵的质量进行计算,即可得计算出硝酸铵的质量分数,而后利用硝酸铵的含氮量即可计算出该样品的含氮量,进而可以判断该产品是否合格;
解答:解:(1)由题意知铵态氮肥与碱能够放出氨气,所以铵态氮肥不能与碱性肥料混合使用,以免降低肥效;
(2)设5g样品中硝酸铵的质量是x
NH4NO3+NaOH=NaNO3+NH3↑+H2O
80 17
x 0.85g
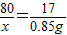
x=4g
所以样品中硝酸铵的质量分数为
 ×100%=80%
×100%=80%硝酸铵的含氮量是
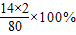 =35%
=35%所以样品中氮元素的质量分数为35%×80%=28%<34.0%
故该化肥不合格;
故答案为:(1)不能与碱性肥料混合使用;(2)该化肥不合格;
点评:本题主要考查了化合物中某元素的质量分数和物质的纯度的有关知识,属于化学方程式与化学式计算的综合考查题;

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
小强在公共场所围墙上看到一则化肥广告(如右图),他通过计算判断出该广告是虚假广告,并向有关部门反映.
| 国内首创 优质硝酸铵 NH4NO3 含氮量全球最高 (氮的质量分数38%)(1)请计算硝酸铵中各元素的质量比.(请写出详细的计算过程) (2)已知该产品中的杂质不含氮元素,请你尝试写出小强的计算过程和判断依据.(请写出详细的计算过程) (3)技术监督局对该产品进行取样分析,发现氮元素的质量分数仅为28%.请计算该产品中硝酸铵的质量分数.(请写出详细的计算过程)
小强在公共场所围墙上看到一则化肥广告(如右图),他通过计算判断出该广告是虚假广告,并向有关部门反映.
(2)已知该产品中的杂质不含氮元素,请你尝试写出小强的计算过程和判断依据.(请写出详细的计算过程) (3)技术监督局对该产品进行取样分析,发现氮元素的质量分数仅为28%.请计算该产品中硝酸铵的质量分数.(请写出详细的计算过程) |