题目内容
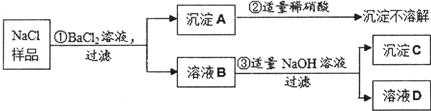
(7分)红枣包装中常使用一种“504双吸剂”,其成分为铁粉、生石灰等。实验小组同学对一包使用过的“504双吸剂”进行了如下探究。
【提出问题】使用后固体的成分是什么?
【查阅资料】Fe + 2FeCl3 === 3FeCl2
【进行猜想】固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
【进行实验】
甲同学的实验记录:
实验质疑:你认为甲同学得出的实验结论是否正确,并阐述理由: 。
乙同学的实验:

综合上述实验过程和数据回答问题:
① 加足量碳酸钠溶液时发生反应的化学方程式为 。
②“504双吸剂”使用后固体的成分是 。
【反思与评价】
依据甲、乙同学的实验,得出的下列结论中,正确的是 (填字母序号)。
A.甲同学实验中得到的浅绿色溶液中溶质一定有FeCl2、CaCl2
B.乙同学实验过程中共有3个反应发生
C.乙同学实验中得到的黄色溶液中溶质为FeCl3、CaCl2
D.甲、乙两位同学实验中都有气体产生,但生成的气体成分不同
【提出问题】使用后固体的成分是什么?
【查阅资料】Fe + 2FeCl3 === 3FeCl2
【进行猜想】固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
【进行实验】
甲同学的实验记录:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放入试管中,滴加一定量的 ,用带导管的单孔塞塞紧试管口,导管另一端伸入澄清石灰水中。 | 试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。 | 固体中一定含有 , 不含Fe2O3。 |
| 取少量固体放入试管中,加水溶解,静置后取上层清液滴加无色酚酞溶液。 | 试管底部有不溶物, 。 | 固体中含有氧化钙和氢氧化钙。 |
乙同学的实验:

综合上述实验过程和数据回答问题:
① 加足量碳酸钠溶液时发生反应的化学方程式为 。
②“504双吸剂”使用后固体的成分是 。
【反思与评价】
依据甲、乙同学的实验,得出的下列结论中,正确的是 (填字母序号)。
A.甲同学实验中得到的浅绿色溶液中溶质一定有FeCl2、CaCl2
B.乙同学实验过程中共有3个反应发生
C.乙同学实验中得到的黄色溶液中溶质为FeCl3、CaCl2
D.甲、乙两位同学实验中都有气体产生,但生成的气体成分不同
| 实验操作 | 实验现象 | 实验结论 |
| 稀盐酸 | | Fe和CaCO3 |
| | 试管壁有热感,溶液由无色变成红色 | |
不正确。氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁,因此不能说明固体中没有Fe2O3;氧化钙和水反应能生成氢氧化钙,滴加无色酚酞溶液后溶液一定会变为红色,因此不能证明固体中有氢氧化钙。
① Ca(OH)2 + Na2CO3 ===CaCO3↓+ 2NaOH
② Fe、Fe2O3、CaO、Ca(OH)2 、CaCO3
【反思与评价】A D
试题分析:(1) 结合固体成分可能含有Fe、和CaCO3,都能与酸反应:Fe + 2HCl="==" FeCl2 + H2↑,形成亚铁离子,得到浅绿色溶液,CaCO3+2HCl==CaCl2+H2O+CO2↑,产生二氧化碳,使清石灰水变浑浊,所以应该滴加一定量的稀盐酸,根据现象,实验结论是固体中一定含有Fe和CaCO3 Fe和CaCO3,不含Fe2O3,因为Fe2O3会与盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O,得到的是黄色的溶液,第二步是根据氧化钙能与水反应,并且放出大量的热,氢氧化钙溶液呈碱性,所以根据结论:固体中含有氧化钙和氢氧化钙,现象应该是:试管壁有热感,溶液由无色变成红色
实验质疑:
不正确。氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁,因此不能说明固体中没有Fe2O3;氧化钙和水反应能生成氢氧化钙,滴加无色酚酞溶液后溶液一定会变为红色,因此不能证明固体中有氢氧化钙
①因为加足量碳酸钠溶液,得到滤渣,所以化学方程式为: Ca(OH)2 + Na2CO3 ===CaCO3↓+ 2NaOH,用磁铁吸引,得到0.4g固体,说明有铁,在0.95g固体中加入盐酸,有气体产生且溶液为黄色溶液,说明含有Fe2O3、CaCO3,再根据化学反应:Ca(OH)2 + Na2CO3 ===CaCO3↓+ 2NaOH中碳酸钙与Ca(OH)2的质量关系=100:74,而碳酸钙质量为1g,所以Ca(OH)2的质量为0.74g,如果没有CaO,那么0.74g+0.95g>1.6g,所以说明固体中还含有氧化钙,②“504双吸剂”使用后固体的成分是:Fe、Fe2O3、CaO、Ca(OH)2 、CaCO3
【反思与评价】A、甲同学实验中发生两个反应:Fe + 2HCl="==" FeCl2 + H2↑和CaCO3+2HCl==CaCl2+H2O+CO2↑,所以得到的浅绿色溶液中溶质一定有FeCl2、CaCl2,B、乙同学实验过程中共发生四个反应:1、CaO + H2O ="=" Ca(OH)2,2、Ca(OH)2+Na2CO3==CaCO3↓+2NaOH,3、CaCO3+2HCl==CaCl2+H2O+CO2↑,4、Fe2O3+6HCl==2FeCl3+3H2O,C、乙同学实验中得到的黄色溶液中溶质除了生成FeCl3、CaCl2,还有HCl,D甲、乙两位同学实验中都有气体产生,但生成的气体成分不同,甲产生的是氢气,乙同学产生的是二氧化碳,故选A、D2O3、CaO、Ca(OH)2 、CaCO3的化学性质

练习册系列答案
相关题目

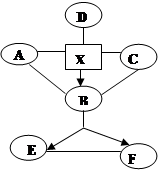
 ”表示一种物质转化成另一种物质,X的水溶液遇硝酸钡溶液产生不溶于硝酸的白色沉淀,D是生活中常见金属,与X反应产生气泡,溶液变浅绿色,A、B、C、D属于不同类别的物质。完善这个知识网络:
”表示一种物质转化成另一种物质,X的水溶液遇硝酸钡溶液产生不溶于硝酸的白色沉淀,D是生活中常见金属,与X反应产生气泡,溶液变浅绿色,A、B、C、D属于不同类别的物质。完善这个知识网络: