题目内容
【题目】勇往直前学习小组的同学在进行酸、碱的化学性质的实验活动。同学们的实验步骤如图所示
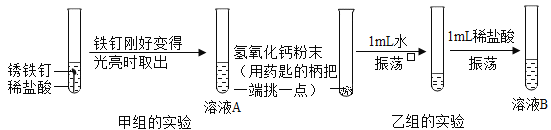
(收集证据)取用氢氧化钙时“用药匙的柄把一端挑一点”的目的是_____
(继续实验)为妥善处理实验后所得到的废液,同学们将试管内的溶液A、B混入同一废液缸中,开始无明显现象,一段时间后出现了红褐色沉淀,过滤得到无色滤液,同学们对无色滤液中的离子组成产生了兴趣,进行继续探究:
(提出问题)除Cl-外,废液缸中还含有哪几种离子?
(猜想与假设)小冰:H+、Ca2+、Fe3+ 小城:Ca2+、OH- 小美:______
上述猜想中,小冰的猜想一定是错误的,不需验证,理由是_____.
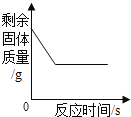
(设计实验)为得出结论,同学们设计了下图实验根据实验现象可以得出_____的猜想是正确的,从而得出结论。

(总结与归纳)回顾整个实验过程,可以归纳出氢氧化钙的化学性质是与酸、某些盐溶液反应,同时蓝色沉淀还可归纳出:分析反应后溶液的离子组成时,除了有无色滤液时可以依据溶液的颜色外,更多时候是根据两种废液混合后产生的____来推知某些离子的有无。
【答案】节约药品 Ca2+ 过滤得到无色滤液,而Fe3+在溶液中显黄色,并且废液缸内已经生成Fe(OH)3沉淀,说明滤液中一定不含与之不共存的H+ 小城 实验现象
【解析】
[收集证据]
取用氢氧化钙时“用药匙的柄把一端挑一点”的目的是节约药品。
故填:节约药品。
[猜想与假设]
小冰:如果稀盐酸过量时,溶液中的离子除Cl-外有H+、Ca2+、Fe3+
小城:如果氢氧化钙过量,溶液中的离子除Cl-外有Ca2+、OH-
小美:如果氢氧化钙和稀盐酸恰好完全反应,溶液中的离子除Cl-外有Ca2+;
上述猜想中,小冰的猜想一定是错误的,不需验证,理由是:过滤得到无色滤液,而Fe3+在溶液中显黄色,并且废液缸内已经生成Fe(OH)3沉淀,说明滤液中一定不含与之不共存的H+。
故填:Ca2+;废液缸内已经生成Fe(OH)3沉淀,说明滤液中一定不含与之不共存的H+。
[设计实验]
为得出结论,同学们设计了下图实验,根据向溶液中加入硝酸铜溶液,溶液中产生蓝色沉淀,证明溶液中含有氢氧化钙,可以得出小城的猜想是正确的,从而得出结论。
故填:小城。
[总结与归纳]
回顾整个实验过程,可以归纳出氢氧化钙的化学性质是与酸(能和稀盐酸反应)、某些盐(能和硝酸铜反应)反应,同时还可归纳出:分析反应后溶液的离子组成时,除了有时可以依据溶液的颜色外,更多时候是根据两种废液混合后产生的实验现象来推知某些离子的有无。
故填:实验现象。

 轻松暑假总复习系列答案
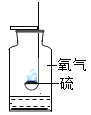
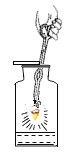
轻松暑假总复习系列答案【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 (氢气难溶于水) |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,后便于观察氢气何时收集满 |
A.AB.BC.CD.D