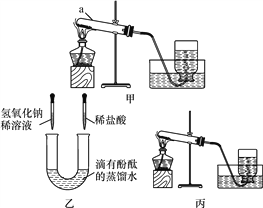
题目内容
【题目】小明、小芳两位同学为探究盐酸的化学性质,做了如下实验:
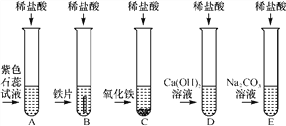
(1)试管A中的现象是________________,反应后试管B中一定有的阳离子是________(写离子符号)。
(2)试管C中反应的化学方程式为________________________。
小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。过滤,得到白色沉淀和无色滤液。
小芳同学欲探究无色滤液中的溶质成分:
小芳同学分析得出无色滤液中一定不含HCl,理由是_______________________________。
【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl、CaCl2和Na2CO3;④NaCl和Na2CO3。
小明认为猜想________一定不正确。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想________成立 |
②取少量滤液于试管中,滴加少量________________ | 有气泡产生 |
【答案】 溶液变为红色 Fe2+ 6HCl+Fe2O3===2FeCl3+3H2O 白色沉淀是碳酸钙,如果有盐酸,它们会发生反应 ③ 盐酸(或稀硫酸等酸) ④
【解析】(1)根据紫色石蕊溶液遇酸性溶液变红解答;根据铁与稀盐酸反应生成氯化亚铁解答;
(2)根据氧化铁与稀盐酸反应生成氯化铁和水解答;根据HCl会与白色沉淀碳酸钙反应解答;
【作出猜想】根据氯化钙和碳酸钠不能共存解答;
【进行实验】①根据碳酸钠会与氯化钙反应生成沉淀解答;
②根据碳酸钠与稀盐酸反应产生气泡解答。
解:(1)紫色石蕊溶液中加入盐酸,溶液变为红色;反应后试管B中生成氯化亚铁,故一定有的阳离子是Fe2+;
(2)试管C中发生氧化铁与盐酸反应生成氯化铁和水,故反应的化学方程式为6HCl+Fe2O3=2FeCl3+3H2O;把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。过滤,得到白色沉淀和无色滤液。产生的沉淀为碳酸钙,故小芳同学分析得出无色滤液中一定不含HCl,理由是因为白色沉淀是碳酸钙,如果有盐酸,它们会起反应;
【作出猜想】因为③NaCl、CaCl2和Na2CO3中,氯化钙和碳酸钠能发生反应,故小明认为猜想③一定不正确;
【进行实验】①取少量滤液于试管中,滴加少量碳酸钠溶液,无明显现象,说明无色滤液中不含氯化钙;②取少量滤液于试管中,滴加少量盐酸(或稀硫酸等酸),有气泡,说明含有碳酸钠,故猜想④正确。

【题目】维生素C(简称Vc,又名抗坏血酸),易溶于水,易被氧化。人体缺乏Vc可能引发多种疾病。水果和蔬菜中含有丰富的Vc。某研究性学习小组对它探究如下:
探究一:测定饮料中Vc的含量。
【查阅资料】Vc能和高锰酸钾反应,使紫色的高锰酸钾溶液褪色。
【设计方案】分别向盛有1 mL等浓度高锰酸钾稀溶液的四支试管中逐滴滴加果味饮料、苹果汁、梨汁和0.04%的Vc溶液,边滴边振荡,直至高锰酸钾溶液褪色。
【实验数据】
果味饮料 | 苹果汁 | 梨汁 | 0.04%的Vc溶液 | |
滴加的滴数 | 40 | 10 | 20 | 5 |
【实验结论】分析数据可知,Vc含量最高的是 ,含量为 (各液体密度上的差别和每一滴的体积差别忽略不计)。
探究二:蔬菜放置时间的长短对其Vc含量是否有影响。
【设计方案】请你用新鲜的黄瓜、放置一周的黄瓜、高锰酸钾稀溶液和必要的仪器设计实验方案: 。
【实验结论】按上述方案实验,根据 这一实验结果,分析得出蔬菜放置时间的长短对其Vc的含量有影响。
【实验反思】化学实验需要控制变量。下列情况不会影响到测定结果的是 。
A.每次实验所用的果汁颜色不同
B.量取的被测物质的体积不同
C.试管的大小不同
D.没有用同一规格胶头滴管滴加