题目内容
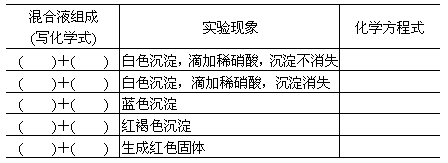
| 混合物 | 除去杂质所用试剂 (用化学式表示) |
写出除去杂质的化学方程式 |
| 铜(氧化铜) | ||
| 氯化锌(氯化铜) | ||
| 硝酸钠(硝酸钙) | ||
| 氯化钠(硫酸铜) |
要除去氯化锌溶液中的氯化铜,实质就是除去铜离子,可利用氯化铜与锌粉反应生成氯化锌和铜,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:Zn+CuCl2═ZnCl2+Cu.
要除去硝酸钠中的硝酸钙,实质就是除去钙离子,可利用硝酸钙溶液与碳酸钠反应生成碳酸钙沉淀和硝酸钠溶液,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:Na2CO3+Ca(NO3)2═CaCO3↓+2NaNO3.
要除去氯化钠溶液中的硫酸铜,实质就是除去铜离子和硫酸根离子,可利用硫酸铜液与适量的氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:Ba(OH)2+CuSO4═Cu(OH)2↓+BaSO4↓.
故答案为:
| 混合物 | 除去杂质所用试剂 (用化学式表示) |
写出除去杂质的化学方程式 |
| 铜(氧化铜) | H2SO4 | CuO+H2SO4═CuSO4+H2O |
| 氯化锌(氯化铜) | Zn | Zn+CuCl2═ZnCl2+Cu |
| 硝酸钠(硝酸钙) | Na2CO3 | Na2CO3+Ca(NO3)2═CaCO3↓+2NaNO3 |
| 氯化钠(硫酸铜) | Ba(OH)2 | Ba(OH)2+CuSO4═Cu(OH)2↓+BaSO4↓ |

小丽同学在一次课外实验探究酸的化学性质时误将过氧化氢(H2O2)溶液当作酸与氧化铁(Fe2O3)粉末混合,发现有大量气泡产生。她联想到二氧化锰(MnO2)可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能否作为H2O2分解的催化剂。
【实验验证】小丽同学一次设计了三个实验
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,观察到木条没有复燃,说明H2O2溶液常温下分解缓慢。
实验二 在实验一的试管中加入wg Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,观察到木条复燃,说明 。
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为wg,说明 。
【实验结论】小丽同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。
【反思评价】小江同学认为要证明小丽同学的结论正确,仅做这三个实验还不充分,需要补充一个探究实验,探究Fe2O3粉末的化学性质在反应前后没变.
【拓展】下表是同学们探究影响H2O2分解因素时所记录的部分数据:
用足量等体积H2O2溶液制取相同体积O2所需时间
|
时间/min
催化剂 | 30%H2O2 溶液 | 15%H2O2 溶液 | 5%H2O2 溶液 |
| 加入wg MnO2 | 0.2 | 0.8 | 2.0 |
| 加入wg Fe2O3 | 7.0 | 9.0 | 16.0 |
通过对表格中的数据进行分析,你能得出的结论是 。
【延伸】 小明同学看到Fe2O3也能做H2O2分解的催化剂,还联想到一种蓝色的CuSO4溶液也能做H2O2分解的催化剂,请你一起参与计算:
 浓度
浓度