题目内容
化学实验室的开放日,老师安排兴趣小组的同学们作如下的实验研究:(1)第一小组的同学将失去标签的两瓶无色溶液(分别为NaCl和Na2CO3)区分开来,为了区别无色溶液,甲、乙、丙、丁四位同学分别选择下列物质进行实验.你认为其中合理的试剂是______(填写序号)
甲:稀盐酸 乙:硝酸银 丙:澄清石灰水 丁:蓝色石蕊试纸
(2)第二小组的同学为除去NaCl溶液中的少量 Na2CO3,设计了如下实验:

①写出沉淀A的化学式______;
②甲同学认为:蒸发所需的仪器有铁架台(带铁圈)、蒸发皿、酒精灯和______;
③乙同学认为:加入过量CaCl2溶液不妥,其原因为______.
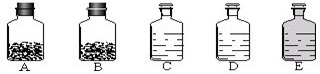
(3)第三小组同学了解到“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如下图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”.

某同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是______(填名称);
②分别打开C、D瓶的瓶塞,观察到______,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸.
(4)第四小组同学称取市售的纯碱样品12g加入适量水,再加入适量CaCl2溶液(所含杂质均可溶于水,且不参加反应),搅拌、过滤、洗涤、干燥后称得固体质量为10.0g:①求该样品中纯碱的质量分数;②若加入水和CaCl2溶液总质量为100g,则生成物溶液中溶质NaCl的质量分数为多少?
[计算过程].
【答案】分析:(1)可根据碳酸钠的化学性质即与酸反应产生二氧化碳气体、与澄清石灰水反应产生沉淀、其水溶液显碱性来鉴别;(2)根据碳酸钠与氯化钙反应的产物考虑沉淀的化学式,根据蒸发用到的仪器考虑;加入过量的氯化钙溶液会使氯化钠溶液中混有氯化钙不纯;(3)根据浓硝酸和浓盐酸易挥发进行分析;(4)根据沉淀的质量计算出碳酸钠的质量,再用碳酸钠的质量除以样品的质量,根据沉淀的质量计算出生成的氯化钠的质量,再除以总溶液的质量即可.
解答:解:(1)Na2CO3溶液能与稀盐酸反应生成二氧化碳气体,有明显现象,却不与NaCl溶液反应;Na2CO3溶液能和澄清石灰水反应产生沉淀,有明显现象,硝酸银与氯化钠以及碳酸钠均能反应生成白色沉淀;Na2CO3溶液显碱性,所以无法采用蓝色的石蕊试纸验证溶液的碱性,所以合理的是:甲、丙;
(2)①上述流程图中知,碳酸钠能和过量的石灰水反应生成沉淀物,沉淀的化学式为CaCO3;
②蒸发时用到的仪器有:铁架台(带铁圈)、蒸发皿、酒精灯和玻璃棒;
③加入过量的氯化钙溶液会使氯化钠溶液中混有氯化钙溶液,蒸发溶剂后得到氯化钠和氯化钙的混合物,所以获得氯化钠不纯.
(3)浓硝酸有强烈的挥发性,浓硝酸因溶解由分解产生的NO2而呈黄色,常将浓硝酸盛放在棕色试剂瓶中,浓盐酸会发出的氯化氢气体和空气中的水蒸气结合形成的盐酸小液滴,在瓶口形成白雾;
(4)设生成10g沉淀需要参加反应的碳酸钠的质量为X生成氯化钠的质量为Y则:
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
X 10g Y
根据: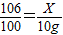 解得X=10.6g,根据:
解得X=10.6g,根据: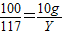 解得Y=11.7g
解得Y=11.7g
①该样品中纯碱的质量分数: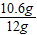 ×100%=88.3%;
×100%=88.3%;
②生成物溶液中溶质NaCl的质量分数为: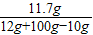 ×100%=11.47%
×100%=11.47%
故答案为:(1)甲、丙;(2)①CaCO3;②玻璃棒;③加入过量的氯化钙溶液会使氯化钠溶液中混有氯化钙溶液不纯;(3)浓硝酸;C瓶的瓶口冒白雾;(4)①88.3%;②11.47%.
点评:此题涉及到实验的常规操作,相关的物质的分离等,纵纵观这些化学式的考查实际还是与物质之间的反应有关系,因此学好物质间的联系是酸碱盐知识的关键.
解答:解:(1)Na2CO3溶液能与稀盐酸反应生成二氧化碳气体,有明显现象,却不与NaCl溶液反应;Na2CO3溶液能和澄清石灰水反应产生沉淀,有明显现象,硝酸银与氯化钠以及碳酸钠均能反应生成白色沉淀;Na2CO3溶液显碱性,所以无法采用蓝色的石蕊试纸验证溶液的碱性,所以合理的是:甲、丙;
(2)①上述流程图中知,碳酸钠能和过量的石灰水反应生成沉淀物,沉淀的化学式为CaCO3;
②蒸发时用到的仪器有:铁架台(带铁圈)、蒸发皿、酒精灯和玻璃棒;
③加入过量的氯化钙溶液会使氯化钠溶液中混有氯化钙溶液,蒸发溶剂后得到氯化钠和氯化钙的混合物,所以获得氯化钠不纯.
(3)浓硝酸有强烈的挥发性,浓硝酸因溶解由分解产生的NO2而呈黄色,常将浓硝酸盛放在棕色试剂瓶中,浓盐酸会发出的氯化氢气体和空气中的水蒸气结合形成的盐酸小液滴,在瓶口形成白雾;
(4)设生成10g沉淀需要参加反应的碳酸钠的质量为X生成氯化钠的质量为Y则:
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
X 10g Y
根据:
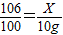 解得X=10.6g,根据:
解得X=10.6g,根据: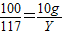 解得Y=11.7g
解得Y=11.7g①该样品中纯碱的质量分数:
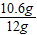 ×100%=88.3%;
×100%=88.3%;②生成物溶液中溶质NaCl的质量分数为:
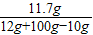 ×100%=11.47%
×100%=11.47%故答案为:(1)甲、丙;(2)①CaCO3;②玻璃棒;③加入过量的氯化钙溶液会使氯化钠溶液中混有氯化钙溶液不纯;(3)浓硝酸;C瓶的瓶口冒白雾;(4)①88.3%;②11.47%.
点评:此题涉及到实验的常规操作,相关的物质的分离等,纵纵观这些化学式的考查实际还是与物质之间的反应有关系,因此学好物质间的联系是酸碱盐知识的关键.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目