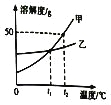
题目内容
【题目】实验室常用块状大理石和稀盐酸制取CO2气体。
(1)写出实验室制取CO2的化学方程式:_______________。
(2)若用右图所示装置(固定装置省略)制CO2:连接好装置后,需检查装置的气密性。具体操作方法是:先______,后_______,若导管口有气泡,放手后导管内上升一段稳定的水柱,则气密性良好。(填序号)
A.用手捂住试管 B.将导管一端浸入水中
(3)实验室收集CO2可用的方法是_______(填序号)。
A.排水法 B.向下排空气法 C.向上排空气法
(4)实验室常用澄清石灰水检验CO2,写出反应的化学方程式:______________。
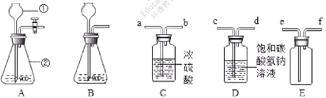
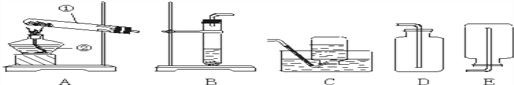
(5)某些大理石中含少量硫化物,使制得的CO2中混有H2S气体。欲获取纯净、干燥的CO2,需对发生装置中产生的气体进行除杂,实验装置如图:
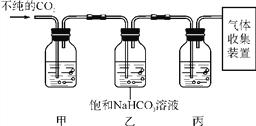
查阅资料:I.H2S能与NaOH等碱溶液、CuSO4溶液反应。Ⅱ.CO2中混有的HCl气体可用饱和NaHCO3溶液吸收。
①装置甲中所盛试剂应选用________(填序号)。
A.浓硫酸 B.NaOH溶液
C.澄清石灰水 D.CuSO4溶液
②装置丙的作用是______________________。
【答案】 CaCO3+2HCl===CaCl2+H2O+CO2↑ B A C CO2+Ca(OH)2===CaCO3↓+H2O D 除去CO2中的水蒸气(或干燥CO2)
【解析】(1)大理石的主要成分是碳酸钙,和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)在连接好装置后,将导管一端伸入水中,用手捂住试管,若导管口有气泡冒出,且松手后导管内形成一段水柱,则气密性良好;
(3)二氧化碳的密度比空气大且能溶于水,所以可用向上排空气法收集;
(4)检验二氧化碳气体用澄清的石灰水,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
(5)①乙装置中的碳酸氢钠溶液是用来除去二氧化碳中混有的氯化氢气体的,则装置甲中所盛试剂是用来除硫化氢气体的,且不与氯化氢反应,所以是硫酸铜溶液;
②甲装置中的硫酸铜溶液除去了二氧化碳中混有的硫化氢气体,乙装置中的碳酸氢钠溶液除去了二氧化碳中混有的氯化氢气体,则装置丙是用浓硫酸来吸收二氧化碳中的水蒸气进行干燥。

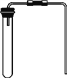
【题目】下图是木炭还原氧化铜的探究实验装置。
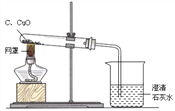
【提出问题】木炭还原氧化铜产生什么气体?
【提出猜想】产生的气体有三种情况:⑴CO,⑵CO2, ⑶ ______________。
【设计方案】实验前后分别对试管和烧杯里的物质进行称量,数据设计如下:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | M1 | M2 | △m1即( M1-M2) |
烧杯+澄清石灰水 | M3 | M4 | △m2即( M4-M3) |
(1)若△m2=0,说明反应产生的气体不能被澄清石灰水吸收,则猜想__________成立。
(2)若猜想②正确,理论上△m1与△m2 的关系是:△m1______△m2(填“>”、“<”或“=”)。
【实验并记录】实验得到的数据如下表:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | 69.8g | 65.4g | △m1 |
烧杯+澄清石灰水 | 118.8g | 122.6g | △m2 |
用以上实验数据分析,结果应该是猜想________成立。
【反思与评价】经查阅资料知道:木炭还原氧化铜产生CO2气体,该反应的化学方程式为:_____。本次实验结果与资料显示不一致。对其可能原因有同学提出下列分析,其中合理的是__________。
A.装置漏气 B.生成的CO2部分与过量的C反应生成了CO
C.澄清石灰水吸收CO2效果不好 D.装置内还有CO2气体未被吸收