题目内容
【题目】某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”.
(分析提纯方法)
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S | S≥10g | 1g≤S<10g | 0.01g≤S<1g | S<0.01g |
溶解性 | 易溶 | 可溶 | 微溶 | 难溶 |
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
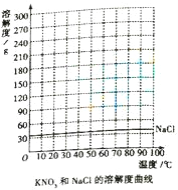
(1)①常温下,KNO3和NaCl的溶解性均为______。
③根据KNO3的溶解度曲线,获得KNO3在70℃时的溶解度约为 ______g.
(2)(设计提纯步骤)
①选取样品(95gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约56.2mL,水的密度约为1gmL﹣1)
③降温至20℃
④得到晶体
(设计提纯方案)
为了证明④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水铬固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加________,观察实验现象.
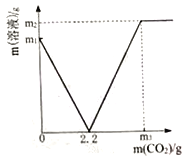
方案二 计算析出KNO3晶体的质量约为________g(精确到0.1g)与(4)中得到晶体的质量进行比较;
方案三________与95%进行比较;
方案四________.
【答案】易溶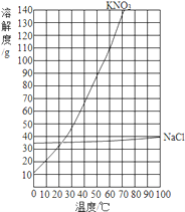 138硝酸银77.282%利用20.2g与5g进行比较
138硝酸银77.282%利用20.2g与5g进行比较
【解析】
(1)①由表二可知,20℃时,NaCl和KNO3的溶解度分别为31.6g和36.0g,均大于10g,所以常温下,KNO3和NaCl的溶解性均为易溶;
②根据表格中硝酸钾在不同温度下的溶解度,用横坐标表示温度,纵坐标表示物质的溶解度,可画出其溶解度曲线;
③所绘制的曲线,找出KNO3曲线中横坐标为70时所对应的纵坐标的数值,为138,所以在70℃时KNO3的溶解度约为138g;
(2)①假设④中的晶体是纯净的KNO3,则所配制的溶液中不含NaCl,因此可滴加硝酸银溶液来检验溶液中是否含NaCl,若有白色沉淀产生,则证明有NaCl,晶体④不是纯净的KNO3,反之晶体则是纯净的KNO3;
②20℃时,硝酸钾的溶解度为31.6g,设在该温度下的56.2g水中最多溶解硝酸钾的质量为x,则![]() ,得x=17.8g,则析出硝酸钾晶体的质量为:95g-17.8g=77.2g;
,得x=17.8g,则析出硝酸钾晶体的质量为:95g-17.8g=77.2g;
③析出晶体中硝酸钾所占的比例![]() ,因此82%与95%进行比较。
,因此82%与95%进行比较。
④20℃时,氯化钠的溶解度为36.0g,设在该温度下的56.2g水中最多溶解氯化钠的质量为y,则![]() ,得y=20.2g,则在20℃时,56.2g水中可以溶解氯化钠20.2g,大于5g,则实验中加入的5g氯化钠可以全部溶解。
,得y=20.2g,则在20℃时,56.2g水中可以溶解氯化钠20.2g,大于5g,则实验中加入的5g氯化钠可以全部溶解。

 阅读快车系列答案
阅读快车系列答案【题目】据统计,我国仅20世纪90年代就发生火灾约89万起,给人民造成重大损失。应用化学知识能有效预防和控制火灾。下面对图中灭火实例的灭火原理解释不正确的是( )

灭火实例 | 灭火原理 | |
A | 住宅失火时,消防队员用水灭火 | 降低可燃物的着火点 |
B | 酒精在桌上着火时,用湿抹布盖灭 | 隔绝空气或氧气 |
C | 炒菜油锅着火时,用锅盖盖熄 | 隔绝空气或氧气 |
D | 扑灭森林火灾时,设置隔离带 | 可燃物与燃烧物隔离 |
A. A B. B C. C D. D