题目内容
将Mg、Al两种金属单质分别加入到等质量且足量的稀硫酸中,Mg、Al反应完后所得两种溶液的质量相等.则加入的Mg和Al的质量比是多少?
解:设生成氢气的质量为x,参加反应的镁的质量为y,参加反应的铝的质量为z.
Mg+H2SO4=MgSO4+H2↑
24 2
y x
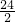 =
=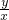 ,
,
y=12x
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
z x
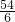 =
=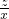 ,
,
z=9x
因此加入的镁和铝的质量比为12x:9x=4:3
答:加入的镁和铝的质量比为4:3.
分析:由于反应后所得两种溶液的质量相等,说明产生氢气的质量相等.利用产生氢气的质量,根据金属与稀硫酸反应的化学方程式,可以计算出参加反应的金属的质量.再用金属的质量相比,即可得到本题的答案.
点评:本题主要考查根据化学方程式的计算.解答本题的关键是根据所得溶液的质量相等判断出生成氢气的质量相等,依据生成氢气的质量才能计算出参加反应的计算的质量比.
Mg+H2SO4=MgSO4+H2↑
24 2
y x
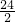 =
=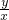 ,
,y=12x
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
z x
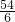 =
=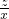 ,
,z=9x
因此加入的镁和铝的质量比为12x:9x=4:3
答:加入的镁和铝的质量比为4:3.
分析:由于反应后所得两种溶液的质量相等,说明产生氢气的质量相等.利用产生氢气的质量,根据金属与稀硫酸反应的化学方程式,可以计算出参加反应的金属的质量.再用金属的质量相比,即可得到本题的答案.
点评:本题主要考查根据化学方程式的计算.解答本题的关键是根据所得溶液的质量相等判断出生成氢气的质量相等,依据生成氢气的质量才能计算出参加反应的计算的质量比.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 (2012?海淀区一模)在户外聚会时,化学老师点燃了一支自制的蜡烛,如图1,同学们发现这支蜡烛不易被风吹灭,原来在蜡烛的棉芯里藏了两根相互缠绕的银白色金属丝.老师指出金属丝的成分可能是Mg、Al、Fe中的一种或两种.回校后,老师提供了Mg、Al、Fe三种已知金属和MgSO4、Al2(SO4)3、FeSO4、CuSO4四种盐溶液,以及未知金属的样品.指导同学们先进行了参照实验,之后探究未知金属的成分.
(2012?海淀区一模)在户外聚会时,化学老师点燃了一支自制的蜡烛,如图1,同学们发现这支蜡烛不易被风吹灭,原来在蜡烛的棉芯里藏了两根相互缠绕的银白色金属丝.老师指出金属丝的成分可能是Mg、Al、Fe中的一种或两种.回校后,老师提供了Mg、Al、Fe三种已知金属和MgSO4、Al2(SO4)3、FeSO4、CuSO4四种盐溶液,以及未知金属的样品.指导同学们先进行了参照实验,之后探究未知金属的成分.