题目内容
 (2013?朝阳区一模)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如图所示.
(2013?朝阳区一模)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如图所示.(1)实验中生成沉淀的最大质量是
5
5
g.(2)开始加入碳酸钠溶液时,还没有产生沉淀的原因是
稀盐酸先与碳酸钠反应
稀盐酸先与碳酸钠反应
.(3)计算原滤液中氯化钙的质量分数.(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl)
分析:(1)根据图示信息可知生成沉淀的最大质量;
(2)根据稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应进行解答;
(3)根据沉淀的最大质量可求出原滤液中氯化钙的质量,然后根据溶质的质量分数的计算方法计算质量分数.
(2)根据稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应进行解答;
(3)根据沉淀的最大质量可求出原滤液中氯化钙的质量,然后根据溶质的质量分数的计算方法计算质量分数.
解答:解:(1)由图可以看出,生成沉淀的最大质量是5g;
(2)因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应,若先与氯化钙反应,生成的碳酸钙沉淀又与盐酸反应;
(3)解:设原滤液中CaCl2的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl …(1分)
111 100
x 5g
=
x=5.55g
故原滤液中氯化钙的质量分数为:
×100%=11.1%
答:原滤液中氯化钙的质量分数是11.1%.
故答案为:(1)5;(2)稀盐酸先与碳酸钠反应;(3)原滤液中氯化钙的质量分数是11.1%.
(2)因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应,若先与氯化钙反应,生成的碳酸钙沉淀又与盐酸反应;
(3)解:设原滤液中CaCl2的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl …(1分)
111 100
x 5g
| 111 |
| x |
| 100 |
| 5g |
x=5.55g
故原滤液中氯化钙的质量分数为:
| 5.55g |
| 50g |
答:原滤液中氯化钙的质量分数是11.1%.
故答案为:(1)5;(2)稀盐酸先与碳酸钠反应;(3)原滤液中氯化钙的质量分数是11.1%.
点评:此题是对物质的性质及图象识别考查题,解题的关键是能对图象有明确的认识,可以较好的培养学生良好的分析问题的能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
 (2013?朝阳区一模)某化学小组同学利用如图所示装置进行实验.
(2013?朝阳区一模)某化学小组同学利用如图所示装置进行实验.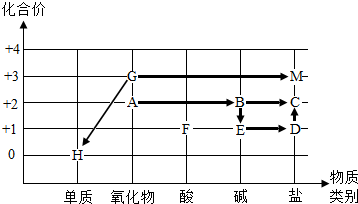 (2013?朝阳区一模)同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).
(2013?朝阳区一模)同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).