题目内容
【题目】(11分)实验室里有一瓶长期暴露在空气中的氢氧化钠固体,某化学兴趣小组对其进行了如下探究。
(1)确定固体的成分。
【提出猜想】猜想Ⅰ:固体中只含碳酸钠;
猜想Ⅱ:固体中只含氢氧化钠;
猜想Ⅲ:固体中含有 。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量固体溶于水,加入 ; | 产生白色沉淀 | 猜想Ⅲ成立 |
②将上述反应后的混合液过滤,取少量滤液,加入 。 |
(2)测定固体中碳酸钠的质量分数。
【查阅资料】二氧化碳几乎不溶于饱和碳酸氢钠溶液中。
【进行实验】取2g固体,在25℃、101kPa下用如图所示装置进行实验,步骤如下:

①连接好装置并检查气密性;
②装入药品,通过分液漏斗滴加足量稀硫酸后,关闭分液漏斗活塞;
③充分反应后,恢复至25℃、101kPa,量筒中液体的体积为220mL。
【实验分析】
①装置B中的饱和碳酸氢钠溶液不能用水代替,原因是 。
②充分反应后,装置A中残留的的二氧化碳对实验结果是否有明显影响? (选填“有”或“没有”)。
③已知在25℃、101kPa下二氧化碳的密度为1.8g/L,则固体中碳酸钠的质量分数为 (结果保留至0.1%)。
(3)除去固体中的碳酸钠。
【进行实验】实验流程如下图:
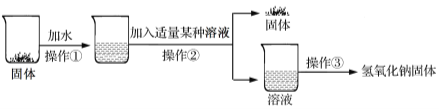
【实验分析】该流程中发生反应的化学方程式为 。
操作①、②、③均需用到的一种仪器是 。
【答案】(1)【提出猜想】氢氧化钠和碳酸钠
【进行实验】①足量BaCl2溶液[或足量Ba(NO3)2溶液] ②无色酚酞溶液 溶液变红
(2)【实验分析】①二氧化碳能溶于水且能与水反应 ②没有 ③47.7%
(3)【实验分析】Na2CO3 + Ba(OH) 2 BaCO3↓+ 2NaOH [或Na2CO3 + Ca(OH) 2 CaCO3↓+ 2NaOH] 玻璃棒
【解析】
试题分析:(1)【提出猜想】猜想Ⅲ:氢氧化钠部分变质,固体中含有氢氧化钠和碳酸钠
【进行实验】要证明猜想Ⅲ成立,即既要证明含有碳酸钠,又要证明含有氢氧化钠,应先证明碳酸钠并且除去碳酸钠,然后再来证明氢氧化钠,故实验步骤①取少量固体溶于水,加足量CaCl2或BaCl2溶液[或足量Ba(NO3)2溶液] ,若有碳酸钠,则会产生白色沉淀,反应为:BaCl2+Na2CO3==BaCO3↓+2NaCl ②将上述反应后的混合液过滤,取少量滤液,加入无色酚酞溶液,若有氢氧化钠,则溶液变红
(2)【实验分析】①装置B中的饱和碳酸氢钠溶液不能用水代替,原因是二氧化碳能溶于水且能与水反应,这样会使二氧化碳的质量减少
②充分反应后,装置A中残留的的二氧化碳对实验结果没有明显影响,因为反应前装置A中就有空气
③根据化学方程式:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑中CO2与Na2CO3的质量关系,可计算出Na2CO3的质量,进一步固体中碳酸钠的质量分数
二氧化碳的质量=1.8g/L×220mL×10-3=0.396g
解:设Na2CO3的质量为x
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
106 44
x 0.396g
106:44=x:0.396g
x=0.954g
固体中碳酸钠的质量分数=0.954g/2g×100%=47.7%
(3)【实验分析】要除去氢氧化钠中的碳酸钠,根据除杂质的原则:加入的物质只能与杂质反应,不能引入新的杂质,故可加入Ba(OH) 2或Ca(OH) 2溶液,发生反应的化学方程式为:Na2CO3 + Ba(OH) 2 BaCO3↓+ 2NaOH [或Na2CO3 + Ca(OH) 2 CaCO3↓+ 2NaOH];操作①、②、③都是将固体和液体分离开来,是过滤,均需用到的一种仪器是:玻璃棒

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案