题目内容
【题目】一金属氧化物中氧元素的质量分数为30%,该金属的相对原子质量为56,则该金属氧化物的化学式为__________,相对分子质量为________,在这种氧化物中金属元素的化合价为__________。
【答案】Fe2O3 160 +3
【解析】
由题意,一金属氧化物中氧元素的质量分数为30%,则该金属元素质量分数为1-30%=70%,该氧化物中金属元素与氧元素的质量比为70%:30%=7:3,则1个该金属氧化物中金属原子和氧原子的个数比为![]() :
:![]() =2:3,该金属的相对原子质量为56,为铁原子,则该金属氧化物的化学式为Fe2O3.
=2:3,该金属的相对原子质量为56,为铁原子,则该金属氧化物的化学式为Fe2O3.
相对分子质量为56×2+16×3=160.
氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:2x+(-2)×3=0,则x=+3价.
故答案为:Fe2O3;160;+3价.

练习册系列答案
相关题目
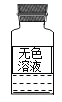
【题目】如图是实验室新配制的一瓶无色溶液,可能是浓氨水、过氧化氢溶液和澄清石灰水中的其中一种。某同学通过如下实验成功鉴别出其成分,请你填写实验报告。
实验操作 | 预计实验现象 | 实验结论及解释 |
打开瓶塞_____ | 无刺激性气味 | _____ |
取少量液体于试管中,加入_____ | _____ | _____ |