题目内容
【题目】某纯净物在氧气中燃烧生成水和二氧化碳两种物质,实验测得1.6g该纯净物在氧气中燃烧后,可生成3.6g水和4.4g二氧化碳,则该纯净物的组成为( )
A. 只含有碳、氢元素
B. 含有碳、氢、氧三种元素
C. 肯定含有碳、氢元素,可能含有氧元素
D. 无法判断
【答案】A
【解析】
根据已有的知识进行分析,化学反应前后元素的种类和质量不变,据此解答即可。
该物质燃烧能生成水和二氧化碳,故该物质中一定含有碳元素和氢元素,
3.6g水中含有氢元素的质量为:3.6gⅹ![]() =0.4g;
=0.4g;
4.4g二氧化碳中含有碳元素的质量为:4.4gⅹ![]() =1.2g;
=1.2g;
碳元素和氢元素的质量和为1.2g+0.4g=1.6g,与该纯净物的质量相等,故该纯净物中只含有碳元素和氢元素,不含有氧元素,观察选项,
故选:A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
探究一 M溶液中的溶质是什么?
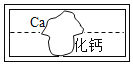
(1)(提出猜想)该组同学认为M溶液的溶质有两种可能:
①是_____,②是CaCl2.
(收集资料)CaCl2水溶液呈中性.
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加_____. | _____ | 猜想①正确,碳酸钠与其反应的化学方程为_____. |
探究二 过滤后澄清滤液中会有哪些溶质?
(提出猜想)猜想一:NaOH和Na2CO3;猜想二:_____;猜想三:NaOH
(3)(实验验证)同学们针对“猜想一”进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | _____ | “猜想一”不成立 |
他们的实验结论是否正确?_____,理由是_____.