题目内容
某同学在实验室利用5%的过氧化氢溶液制取氧气8克,他利用质量守恒定律分析,发现化学反应前后同种元素的质量不变,于是得出反应物过氧化氢中应含有8克氧元素,于是求出需要过氧化氢的质量为8.5克,进而求出需要5%过氧化氢溶液的质量为170克.请运用你的聪明才智分析该同学的计算有无错误?如果你认为正确请按该同学的思路写出计算过程,如果你认为不正确,请说明理由,并重新按步骤计算.
【答案】分析:由氧气的质量根据过氧化氢分解的化学方程式可以计算出过氧化氢的质量,再结合过氧化氢溶液的质量分数可以计算出需要的过氧化氢溶液的质量.
解答:答:该同学的计算有误.
因为反应物过氧化氢中的氧元素并没有全部转移到产物氧气中,所以氧气的质量并不等于过氧化氢中所含氧元素的质量.可通过化学方程式计算.
解:设需要过氧化氢溶液的质量为x,
2H2O2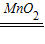 2H2O+O2↑
2H2O+O2↑
68 32
x?5% 8g
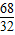 =
= ,x=340g
,x=340g
答:需5%的过氧化氢溶液的质量为340g.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度稍大.
解答:答:该同学的计算有误.
因为反应物过氧化氢中的氧元素并没有全部转移到产物氧气中,所以氧气的质量并不等于过氧化氢中所含氧元素的质量.可通过化学方程式计算.
解:设需要过氧化氢溶液的质量为x,
2H2O2
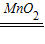 2H2O+O2↑
2H2O+O2↑68 32
x?5% 8g
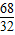 =
= ,x=340g
,x=340g答:需5%的过氧化氢溶液的质量为340g.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度稍大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目