题目内容
 实验是进行科学探究的重要途径.请回答有关问题:
实验是进行科学探究的重要途径.请回答有关问题:
(1)在一次实验中老师表演了“水能生火”的魔术.他向包有过氧化钠(N202)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小磊同学很感兴趣,他和小军进行了如下探究活动.
【提出问题】
过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
【猜想】
①可能有一种气体和另一种物质生成.②反应过程中可能有热量放出.
【设计实验】如图所示
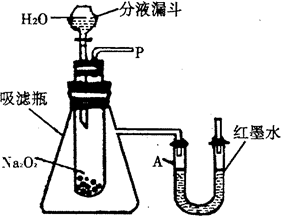
【实验探究】实验一:探究反应后生成的气体是什么?
①小磊猜想生成的气体可能是氢气也可能是氧气,他猜想的依据是________
②小磊打开分液漏斗的活塞后看到Na2O2表面有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是________.
③实验过程中还观察到U形管A端红墨水液面下降,其原因是________.
实验二:继续探究反应.后生成的另-种物质是什么.
①小磊取反应后的溶液于试管内,滴入酚酞试液,发现溶液变红,说明溶液呈________性.
②小军认为纯碱溶液能使酚酞变红,所以另一种物质可能是碳酸钠,小磊认为不可能,
他选用________试剂来验证另一物质是否是Na2CO3.通过以上探究小磊最终得到了满意的答案.
(2)工业用纯碱和熟石灰制烧碱,他们发现某烧碱中含有碳酸钠,为测其纯度小明设计的实验步骤为①在天平的托盘上放大小相同的纸片,左物右码称量20g烧碱样品;②将样品放入烧杯中,加100g水溶解;③向烧杯中滴加稀盐酸至二者恰好完全反应;④根据产生气体的质量计算烧碱的纯度.
(A)该同学设计中的错误是________.
(B)纠正错误后进行实验,得出恰好完全反应时用盐酸73g,反应后烧杯中剩余物的总质量为191.9g,请计算烧碱的纯度(写出计算过程).
解:(1)实验一,根据质量守恒定律,化学反应前后元素的种类不变,猜想生成的气体可能是氢气也可能是氧气;故答案为:①化学反应前后元素的种类不变(或质量守恒定律)②氧气③过氧化钠与水反应放出热量,使瓶中空气受热膨胀,压强增大
实验二,碱性溶液能使酚酞试液变红色,不可能是碳酸钠,因为反应前没有碳元素,碳酸钠可以用稀盐酸石灰水、氯化钙溶液等物质检验.故答案为:①碱 ②稀盐酸(石灰水、氯化钙溶液等)
(2)烧碱具有腐蚀性,应该放在玻璃器皿中称量,故答案为:①把烧碱放纸上称量
②解:生成二氧化碳的质量为:20g+100g+73g-191.9g=1.1g
设样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 1.lg
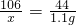
x=2.65g
烧碱的纯度为: ×100%=86.75%
×100%=86.75%
答:烧碱的纯度是86.75%.故答案为:86.75%
分析:根据质量守恒定律,化学反应前后元素的种类不变,猜想生成的气体可能是氢气也可能是氧气;氧气能使带火星的木条复燃;验过程中还观察到U形管A端红墨水液面下降,其原因是:过氧化钠与水反应放出热量,使瓶中空气受热膨胀,压强增大.碱性溶液能使酚酞试液变红色,不可能是碳酸钠,因为反应前没有碳元素,碳酸钠可以用稀盐酸石灰水、氯化钙溶液等物质检验.烧碱具有腐蚀性,应该放在玻璃器皿中称量;有关化学方程式的计算要准确.
点评:有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便;有关化学方程式的计算要准确.
实验二,碱性溶液能使酚酞试液变红色,不可能是碳酸钠,因为反应前没有碳元素,碳酸钠可以用稀盐酸石灰水、氯化钙溶液等物质检验.故答案为:①碱 ②稀盐酸(石灰水、氯化钙溶液等)
(2)烧碱具有腐蚀性,应该放在玻璃器皿中称量,故答案为:①把烧碱放纸上称量
②解:生成二氧化碳的质量为:20g+100g+73g-191.9g=1.1g
设样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 1.lg
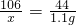
x=2.65g
烧碱的纯度为:
 ×100%=86.75%
×100%=86.75%答:烧碱的纯度是86.75%.故答案为:86.75%
分析:根据质量守恒定律,化学反应前后元素的种类不变,猜想生成的气体可能是氢气也可能是氧气;氧气能使带火星的木条复燃;验过程中还观察到U形管A端红墨水液面下降,其原因是:过氧化钠与水反应放出热量,使瓶中空气受热膨胀,压强增大.碱性溶液能使酚酞试液变红色,不可能是碳酸钠,因为反应前没有碳元素,碳酸钠可以用稀盐酸石灰水、氯化钙溶液等物质检验.烧碱具有腐蚀性,应该放在玻璃器皿中称量;有关化学方程式的计算要准确.
点评:有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便;有关化学方程式的计算要准确.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目