题目内容
某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:①按图连接装置;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为m1克;③准确称得m2克的纯碱样品放入容器b中;④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3克;⑥根据测得的数据分析计算碳酸钠的质量分数。试回答:
(1)在步骤①连接装置后还应 ;
(2)装置A中试剂可选用 ;
(3)写出装置B中的反应方程式 ;
(4)若没有C装置,则会导致测定结果 (填“偏大”或“偏小”);
(5)步骤⑤的目的是__ __;
(6)E装置的作用是__ __。
(1) 检查气密性 ; (2)NaOH ;
(3)Na2CO3 + H2SO4 = Na2SO4+ H2O + CO2↑ ;(4)偏大 ;
(5)把装置中的二氧化碳气体全部排到D装置中被碱石灰吸收 ;
(6)防止外界空气中的水蒸气或二氧化碳进入D而影响测量 。
解析试题分析:(1)由实验步骤可知,连接仪器后要检查装置的气密性。(2)装置A的目的是除去空气中的二氧化碳,故装置A中试剂可选用NaOH;(3)根据化学方程式的书写可得,Na2CO3 + H2SO4 = Na2SO4+ H2O + CO2↑;(4)C装置的作用是干燥二氧化碳,若没有C装置,则D装置中测得二氧化碳的质量偏大,故会导致测定结果偏大;(5)把装置中的二氧化碳气体全部排到D装置中被碱石灰吸收 ;(6)防止外界空气中的水蒸气或二氧化碳进入D而影响测量 。
考点:碳酸盐的性质,物质的制备

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案下列叙述中正确的是( )
| A.Fe与CuSO4反应的基本反应类型属于复分解反应 |
| B.用Na2CO3溶液可以区别Ba(NO3)2、HCl、NaCl三瓶无色溶液 |
| C.木炭在氧气中剧烈燃烧,火星四射,生成黑色固体 |
| D.碳酸氢铵与熟石灰混合施用,既可以增加肥效,又可以改良酸性土壤 |
某化学兴趣小组的同学用洁净的塑料瓶从长江中取回一定量的水样,然后进行如下研究分析:
(1)将浑浊的江水样品倒入烧杯中,加入明矾粉末(吸附杂质,使杂质沉降)搅拌,溶解后静置一会儿;
(2)将静置后的江水采用下图装置进行过滤,请问: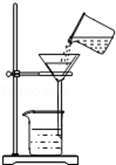
图中还缺少的一种仪器是 ,其作用是 。
(3)过滤后得到的水澄清透明,取其少量于小烧杯中,加入肥皂水并搅拌,发现烧杯中有大量浮渣,则说明河水是 (填“硬水”或“软水”),日常生活中使用硬水会带来许多麻烦,家庭生活中常用来降低水硬度的方法是 。
(4)进行过滤操作时,下列做法正确的是 。
| A.玻璃棒要靠在三层滤纸的一边 | B.漏斗下端的管口要放在烧杯的中间 |
| C.滤纸的边缘要低于漏斗口 | D.液面不要低于滤纸边缘 |
金属在生产和生活中有广泛的应用.
(1)钢铁可以制成炒锅,主要利用了铁的延展性和 性.
(2)下列关于金属的说法正确的是 .
| A.常温下金属均为固态 |
| B.在铁制品表面刷漆防止铁锈蚀 |
| C.铜是目前世界年产量最高的金属 |
| D.金属与酸反应后溶液质量一定增加 |
(3)某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收硫酸锌和有关金属,实验过程如下:
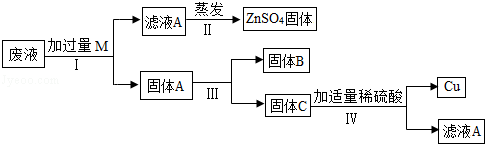
①步骤Ⅰ中加入过量M的目的是 ,写出该步骤中反应的化学方程式 .
②步骤Ⅲ的操作为 .



 ),则可能的原因是(填字母) .
),则可能的原因是(填字母) .