题目内容
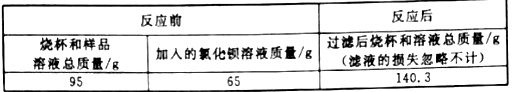
【题目】将碳酸钠和氯化钠的固体混合物17 g放入烧杯中,加100 g水完全溶解,加入50 g稀盐酸,恰好完全反应,待没有气泡逸出后再次称量(CO2的溶解忽略不计),总质量为164.8 g。计算:所得溶液中溶质的质量分数。(计算结果保留至0.1%)
【答案】10.6%
【解析】碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律化学反应前后物质的总质量不变,故减少的质量即为生成的二氧化碳的质量。生成的二氧化碳=17g+100g+50g-164.8g=2.2g 。利用化学方程式,根据物质反应的质量比即可计算出碳酸钠的质量和生成的氯化钠的质量。
设混合物中碳酸钠的质量为x,生成的氯化钠的质量为y;
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
106 117 44
X y 2.2g
![]() x=5.3g
x=5.3g
![]() y=5.85g
y=5.85g
混合物中氯化钠的质量=17g-5.3g=11.7g
溶液中氯化钠的总质量=11.7g+5.85g=17.55g
所得溶液中溶质的质量分数=![]() 10.6%
10.6%
答:所得溶液中溶质的质量分数为10.6% 。

练习册系列答案
相关题目
【题目】下列实验现象描述不正确的是( )
A.白磷自燃产生大量的白烟
B.硫在空气中燃烧,产生淡蓝色火焰
C.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
D.一氧化碳在空气中燃烧发出黄色火焰,生成二氧化碳
【题目】一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见表.下列说法中正确的是( )
物质质量 | 甲 | 乙 | 丙 | 丁 |
反应前 | 25g | x | 5g | 5g |
反应后 | 8g | 23g | 5g | 8g |
A.x=9g
B.该反应是化合反应
C.该反应中,丙物质一定做催化剂
D.在该反应的化学方程式中,丙、丁的化学计量数比为1:1