题目内容
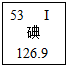 碘元素是人体必需的微量元素之一.
碘元素是人体必需的微量元素之一.(1)右图是元素周期表中碘元素的部分信息.碘原子的核电荷数是
(2)已知某碘盐的主要成分为氯化钠和碘酸钾(KIO3):
①氯化钠含有的阴离子是
②用试剂X测定该碘盐中碘元素的含量,发生如下反应:
KIO3+5X+3H2SO4=3K2SO4+3I2+3H2O,推算X的化学式为
③已知每包碘盐中最多含碘元素15mg,则每包碘盐中最多含KIO3的质量为
分析:(1)根据元素周期表中的一个小格所提供的信息,其中原子序数=核外电子数=质子数,相对原子质量,进行解答;
根据化学元素汉字名称的偏旁可辨别元素的种类,固态非金属元素名称有“石”字旁;
(2)①氯化钠含有的阴离子是氯离子;
根据“在化合物中,正负化合价的代数和为零”的原则,解答KIO3中I的化合价;
②根据质量守恒定律:反应前后元素的原子顺利、种类不变,进行解答;
(3)根据物质中某元素的质量=该物质的质量×该元素的质量分数,进行解答.
根据化学元素汉字名称的偏旁可辨别元素的种类,固态非金属元素名称有“石”字旁;
(2)①氯化钠含有的阴离子是氯离子;
根据“在化合物中,正负化合价的代数和为零”的原则,解答KIO3中I的化合价;
②根据质量守恒定律:反应前后元素的原子顺利、种类不变,进行解答;
(3)根据物质中某元素的质量=该物质的质量×该元素的质量分数,进行解答.
解答:解:(1)根据元素周期表中的一个小格所提供的信息,可知碘原子的核电荷数是 53,根据化学元素汉字名称的偏旁可辨别元素的种类,固态非金属元素名称有“石”字旁;因此碘元素属于非金属元素;
(2)①氯化钠含有的阴离子是氯离子;表示为:Cl-;
根据“在化合物中,正负化合价的代数和为零”的原则,可得KIO3中I的化合价为:(+1)+x+(-2)×3=0;x=+5;
②根据质量守恒定律:反应前后元素的原子顺利、种类不变,推断X的化学式为:KI;
(3)设每包碘盐中最多含KIO3的质量为y
15=y×
×100% 则y=15÷(
×100%)=25.3;
故答案为:(1)53;非金属;
(2)Cl-;+5; KI;
(3)15÷(
×100%)(或15÷(
×100%)或约25.3 ).
(2)①氯化钠含有的阴离子是氯离子;表示为:Cl-;
根据“在化合物中,正负化合价的代数和为零”的原则,可得KIO3中I的化合价为:(+1)+x+(-2)×3=0;x=+5;
②根据质量守恒定律:反应前后元素的原子顺利、种类不变,推断X的化学式为:KI;
(3)设每包碘盐中最多含KIO3的质量为y
15=y×
| 126.9 |
| 39+126.9+16×3 |
| 126.9 |
| 39+126.9+16×3 |
故答案为:(1)53;非金属;
(2)Cl-;+5; KI;
(3)15÷(
| 126.9 |
| 39+126.9+16×3 |
| 126.9 |
| 213.9 |
点评:本题考查学生对化合价计算及根据物质中某元素的质量及质量分数计算方法的掌握与在解题中应用的能力.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
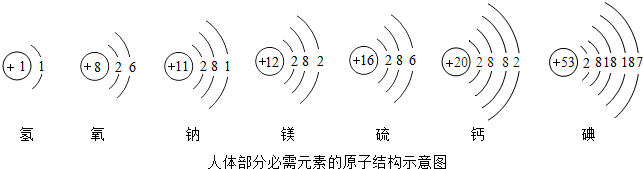
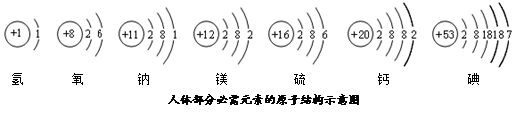

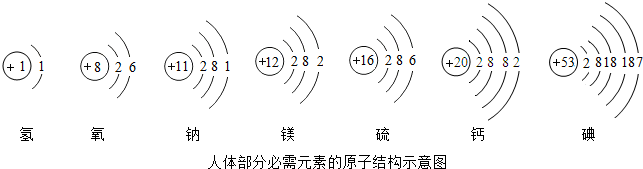
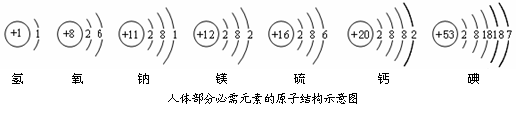 依图填空:
依图填空: ▲ ;
▲ ;