��Ŀ����
����Ŀ����ѧ��ȤС���ͬѧ�ԡ�Ӱ����������ᷴӦ�ľ��ҳ̶ȵ����ء�������̽����
��������⡿���������ᷴӦ���ҳ̶�����Щ���ص�Ӱ�죿
���������롿a.��������������������йأ�b.�����������Ũ���йء�
�����̽����ʵ�����ý���������ɰֽ��ĥ��
��1����ʵ���Ϊ̽������a��С��ͬѧ�ֱ�����֧�Թ��з�����ͬ������пƬ����Ƭ��Ȼ��ֱ�������������Ũ�ȵ�ϡ���ᣬ�۲쵽��пƬ���Թ������������������ݣ�����Ƭ���Թ���ֻ�����������ݡ�д��п�����ᷢ����Ӧ�Ļ�ѧ����ʽ������ʵ��������жϽ�����ԣ�Zn(ѡ���������������)Fe��
��2�����ó����ۡ����������ᷢ����Ӧ�ľ��ҳ̶���������������йأ������Ļ���뷴Ӧ�ľ��ҳ̶ȵĹ�ϵ����
��3����ʵ���Ϊ̽������b��С��ͬѧ�����ͼ��װ�ý���ʵ�飬����ע��������������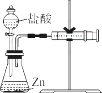
��4������ҩƷ��ʵ�����������
ʵ | ѡ�� | ������ | ||||||
�������������/mL | ||||||||
�� | �� | �� | �� | �� | ǰ5���� | |||
�� | пƬ | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
�� | пƬ | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
���ó����ۡ����������ᷢ����Ӧ�ľ��ҳ̶��������Ũ���йأ����ϵ����
��5������˼���ۡ����ݱ���ʵ������ݷ����������п�����ᷴӦ��������ԭ�� ��
���𰸡�
��1��Zn��2HCl=ZnCl2��H2��,��
��2���������Խǿ,��ӦԽ����
��3��ͨ��ע���������ƶ����������������������
��4������������ͬʱ,����Ũ��Խ��,��ӦԽ����
��5������Ũ�ȱ�С,��Ӧ���ʼ���
����������1�������̽����������֪����Ӧ���������������غ㶨�ɣ���ȷ��д��ѧ����ʽ��п�����ᷴӦ�Ļ�ѧ����ʽΪ��Zn��2HCl=ZnCl2��H2������пƬ���Թ������������������ݣ�����Ƭ���Թ���ֻ�����������ݣ���˽������ǿ��Ϊ��Zn��Fe��
��2���ó����ۣ����������ᷴӦ�ľ��ҳ̶���������������йأ��������Խǿ����ӦԽ���ң���
��3��ʵ�飨2��ע������������ͨ��ע���������ƶ�������ж����������������
��4���ó����ۣ����ݱ�����Ϣ��֪������������ͬʱ������Ũ��Խ��ӦԽ���ң�
��5������˼���ۡ�п�����ᷴӦ����������ٶ��ȼӿ���������Ϊп�������Ƿ��ȷ�Ӧ�����Կ�ʼʱ�¶����ߣ����������ٶȼӿ죬���ŷ�Ӧ�Ľ��̣�����ϱ����ģ�Ũ�Ƚ��ͣ����������ٶȱ���.
�ʴ�Ϊ����1��Zn��2HCl=ZnCl2��H2����������2���������Խǿ����ӦԽ���ң���3��ͨ��ע���������ƶ�������ж������������������4��
����������ͬʱ������Ũ��Խ��ӦԽ���ң���5������Ũ�ȱ�С����Ӧ���ʼ���.
��1��п��ϡ���ᷴӦ�����Ȼ�п����������������ó����ۣ�
��2�����ݽ����Ļ��˳���������Ļ���뷴Ӧ�ľ��ҳ̶ȵĹ�ϵ��
��3��ע��������������ȡ��������������
��4�����ݱ�����Ϣ���Ũ�ȶԷ�Ӧ��Ӱ��������
��5�������ŷ�Ӧ�ľ��ҳ̶������Ũ���йأ���Ϸ�Ӧ�Ĺ��̽��з������.

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�