题目内容
 加碘盐通常在食盐中加碘酸钾(KIO3),下图是超市销售的某种精制碘盐标签上的部分文字说明.请回答下列问题:
加碘盐通常在食盐中加碘酸钾(KIO3),下图是超市销售的某种精制碘盐标签上的部分文字说明.请回答下列问题:(1)碘酸钾(KIO3)中碘元素的化合价为
+5
+5
.(2)如图里“含碘量”中的碘是指
B
B
A.碘酸钾 B.碘元素
C.碘单质 D.碘分子
(3)碘酸钾中钾、碘、氧三种元素质量比为
39:127:48
39:127:48
.(4)碘酸钾中碘元素的质量分数是
59.3%
59.3%
.(结果保留至0.1%)
(5)每袋该食盐中碘元素的质量
10
10
mg.(6)中国营养学会推荐:一个18岁的青年每天摄入碘元素的质量相当于0.253mg碘酸钾中碘元素的质量.假设碘的来源仅靠这种加碘食盐,则该青年每天摄入这种食盐应为
7.5
7.5
g.(结果保留至0.1)(7)根据食用方法我们可以知道碘酸钾的化学性质是
见光、受热易分解
见光、受热易分解
.(8)该精制碘盐除了密封防潮保存外,还要将其放置在
阴凉处
阴凉处
.分析:(1)根据在化合物中正负化合价代数和为零,进行解答;
(2)根据“含碘量”中的碘是指碘元素进行解答;
(3)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
(4)根据某元素的质量分数=
×100%,进行解答;
(5)根据物质中元素的质量=该物质质量×该元素的质量分数,进行解答;
(6)根据0.253mg碘酸钾中碘元素的质量求出氯化钠的质量进行解答;
(7)根据碘酸钾需要避光、避热,可推测碘酸钾的一种化学性质;
(8)根据碘酸钾的性质可知存放方法.
(2)根据“含碘量”中的碘是指碘元素进行解答;
(3)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
(4)根据某元素的质量分数=
| 该元素的相对原子质量×原子个数 |
| 物质相对分子质量 |
(5)根据物质中元素的质量=该物质质量×该元素的质量分数,进行解答;
(6)根据0.253mg碘酸钾中碘元素的质量求出氯化钠的质量进行解答;
(7)根据碘酸钾需要避光、避热,可推测碘酸钾的一种化学性质;
(8)根据碘酸钾的性质可知存放方法.
解答:解:(1)根据在化合物中正负化合价代数和为零,可得碘酸钾(KIO3)中碘元素的化合价为:(+1)+x+(-2)×3=0;则x=+5;
(2)“含碘量”中的碘是指碘元素;
(3)由化合物中各元素质量比=各元素的相对原子质量×原子个数之比可知,碘酸钾中钾、碘、氧三种元素质量比=39:127:(3×16)=39:127:48;
(4)由某元素的质量分数=
×100%可知,碘酸钾(KIO3)中碘元素的质量分数为
×100%=59.3%;
(5)每袋该食盐中碘元素的质量=500g×20mg/1000g=10mg;
(6)0.253mg碘酸钾中碘元素的质量=0.253mg×59.3%=0.15mg,食盐的质量=
=7.5g;
氯化钠的质量进行解答;
(7)需要避光、避热,可推测碘酸钾的一种化学性质为:见光、受热易分解;
(8)该精制碘盐除了密封防潮保存外,还要将其放置在阴凉处.
故答案为:(1)+5;(2)B;(3)39:127:48;(4)59.3%;(5)10;(6)7.5;(7)见光、受热易分解;(8)阴凉处.
(2)“含碘量”中的碘是指碘元素;
(3)由化合物中各元素质量比=各元素的相对原子质量×原子个数之比可知,碘酸钾中钾、碘、氧三种元素质量比=39:127:(3×16)=39:127:48;
(4)由某元素的质量分数=
| 该元素的相对原子质量×原子个数 |
| 物质相对分子质量 |
| 127 |
| 39+127+16×3 |
(5)每袋该食盐中碘元素的质量=500g×20mg/1000g=10mg;
(6)0.253mg碘酸钾中碘元素的质量=0.253mg×59.3%=0.15mg,食盐的质量=
| 0.15mg |
| 20mg/1000g |
氯化钠的质量进行解答;
(7)需要避光、避热,可推测碘酸钾的一种化学性质为:见光、受热易分解;
(8)该精制碘盐除了密封防潮保存外,还要将其放置在阴凉处.
故答案为:(1)+5;(2)B;(3)39:127:48;(4)59.3%;(5)10;(6)7.5;(7)见光、受热易分解;(8)阴凉处.
点评:本题考查学生对化合物中各元素质量比与元素的质量分数计算方法的理解与应用的能力.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).图是超市销售的一种加碘盐标签上的部分文字说明.请回答下列问题:
碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).图是超市销售的一种加碘盐标签上的部分文字说明.请回答下列问题: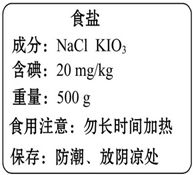 2011年3月,日本核电站泄漏事故备受关注,有谣言称食用加碘盐可以防核辐射,引发多个省市地区出现群众抢购碘盐现象.加碘盐通常在食盐中加碘酸钾(KIO3).如图是超市销售的一种加碘盐标签上的部分文字说明. 请回答下列问题:
2011年3月,日本核电站泄漏事故备受关注,有谣言称食用加碘盐可以防核辐射,引发多个省市地区出现群众抢购碘盐现象.加碘盐通常在食盐中加碘酸钾(KIO3).如图是超市销售的一种加碘盐标签上的部分文字说明. 请回答下列问题:
 碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).如图是超市销售的一种加碘盐标签上的部分文字说明.
碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).如图是超市销售的一种加碘盐标签上的部分文字说明. 碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).图是超市销售的一种加碘盐标签上的部分文字说明.请回答下列问题:
碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).图是超市销售的一种加碘盐标签上的部分文字说明.请回答下列问题: