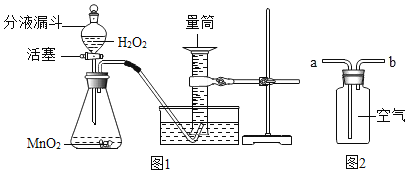
��Ŀ����
����Ŀ���⻯�ƣ�CaH2���ǵ�ɽ�˶�Ա������Դ�ṩ������֪��CaH2 + 2 H2O = Ca��OH��2 + H2����
��1��CaH2 ����Ԫ�صĻ��ϼ�Ϊ______��
��2��д����������ȼ�յĻ�ѧ����ʽ______��
��3����ҵ�г��ø���������Ӧ�Ʊ� CaH2���÷�Ӧ�Ļ�����Ӧ��������______��Ӧ��ijͬѧ��һ������ CaH2���� Na2 CO3��Һ�У���ַ�Ӧ���۲쵽�����ݺͰ�ɫ�������ɣ�������ó����� CaCO3����Ӧ����Һ�е�������һ����______���ѧʽ����
���𰸡�-1 2H2+O2![]() 2H2O ���� NaOH
2H2O ���� NaOH
��������
��1����Ԫ���ڻ������еĻ��ϼ�Ϊ+2�ۣ�����Ԫ�صĻ��ϼ�Ϊx�����ݻ������и�Ԫ�صĻ��ϼ۵Ĵ�����Ϊ�㣬��+2+x��2=0��x=-1������-1��
��2�������������ڵ�ȼ�������·�Ӧ����ˮ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��2H2+O2![]() 2H2O��
2H2O��
��3���������������⻯�����������ʷ�Ӧ����һ�������ʵķ�Ӧ�����ϻ��Ϸ�Ӧ���ص㣬���ڻ��Ϸ�Ӧ������ϣ�
�������֪���⻯����ˮ��Ӧ�����������ƺ����������Խ�һ�������⻯�Ƽ���̼������Һ�У����ȷ����ķ�Ӧ���⻯����ˮ��Ӧ�����������ƺ�������Ȼ������������̼���ܷ�Ӧ����̼��Ƴ������������ƣ���Ӧ����Һ�е�������һ�����������ƣ��仯ѧʽΪNaOH������NaOH��

����Ŀ���ҹ��Ƽҵ������������°�ɹ�̽���Ľ����Ƽ�����±�Ϊ�������ʵ��ܽ�ȡ�
�¶�/��C | 10 | 20 | 30 | 40 | |
�ܽ��/g | Na2CO3 | 12.2 | 21.8 | 39.7 | 48.8 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | |
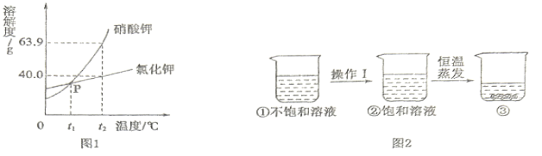
��1��10��C ~40��C,�ܽ�����¶ȱ仯��С������Ϊ_____�������ƣ���
��2���������������ֱ������ʵı�����Һ��40��C������20��C,������Һ�����ʵ����������ɴ�С��˳����_____________���û�ѧʽ��ʾ����
��3���Ƽ�ԭ��:��NaCl��Һ��ͨ������NH3��CO2����NaHCO3�����NH4Cl,NaHCO3���ȷֽ��Ƶô��
I .����NaHCO3�Ļ�ѧ����ʽΪ___��
II .����ϱ���NaHCO3����ᾧ������ԭ�������___������ĸ��ţ���
A ͬ����NaHCO3�ܽ��С��NaCl
B �ܼ���������
C ���ɵ�NaHCO3�����������ĵ�NaCl����