题目内容
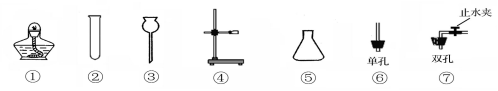
(7分)如图为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器。试根据题目要求,回答下列问题: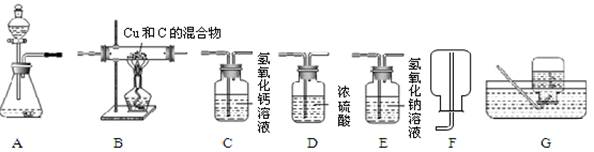
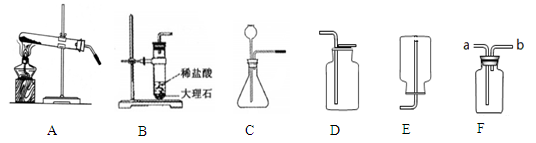
(1)某同学以锌粒和稀盐酸为原料在实验室制备、收集纯净干燥的氢气,选择仪器连接装置后,检查装置的气密性。
①所选装置的连接顺序为 。
②若要验证氢气的可燃性,在点燃氢气之前一定要 。
③写出该同学制备氢气发生反应的化学方程式 。
(2)若以H2O2溶液和MnO2在实验室中制备干燥的氧气,并用来测定B装置中盛有的Cu和C混合物中Cu的含量,取a g混合物样品放入装置B的硬质玻璃管中,所选仪器连接顺序为:
A—D—B—C,试回答下列问题:
①仪器D的作用是 。
②仪器B中的现象是 。
③若通入足量氧气充分反应后,测得B装置中硬质玻璃管内固体的质量在反应前后无变化,则原混合物中Cu的质量是 g。(计算结果可为分数形式)
④欲用化学方法证明硬质玻璃管内的固体在通入氧气后完全发生了反应,请设计实验方案,并简述操作步骤、现象和结论
。
(1)①A E D F ②检验氢气的纯度 ③Zn+2HCl="=" ZnCl2 + H2↑
(2) ①干燥氧气 ②红色的固体变黑 ③4a/5
④取玻璃管内固体加入稀硫酸,若固体全都溶解得到蓝色溶液,则固体在通入氧气后完全发生反应
解析试题分析:(1)①以锌粒和稀盐酸为原料在实验室制取氢气,氢气可能混有水蒸气、氯化氢气体杂质,所以要收集纯净干燥的氢气,应依次除去氯化氢、水蒸气气体杂质,注意顺序不能打乱,又由于氢气的密度比空气小,应采用向下排空气法,不能用排水法,应该要得到干燥的氢气,所以所选装置的连接顺序为:A E D F
②因为可燃性气体和粉尘,在与空气混合,遇到明火或高温,都有可能发生爆炸,所以若要验证氢气的可燃性,在点燃氢气之前一定要检验氢气的纯度
③制备氢气发生反应的化学方程式:Zn+2HCl="=" ZnCl2 + H2↑
(2)①仪器D的作用是:吸收水分,干燥氧气
②仪器B中发生的反应:C + O2点燃 CO2,2Cu + O2△ 2CuO,第一个反应无现象,故第二个反应的现象是:红色的固体变黑
③根据②的分析,发生了2个反应,C + O2点燃 CO2这个反应物质质量减少,且减少的就是碳的质量,而第二个反应2Cu + O2△ 2CuO质量增加,增加的就是CuO中O的质量,因为测得B装置中硬质玻璃管内固体的质量在反应前后无变化,那就意味着减少碳的质量等于增加的就是CuO中O的质量,所以原混合物中Cu的质量就是CuO中Cu的质量=64/80×a=4a/5
④要证明硬质玻璃管内的固体在通入氧气后完全发生了反应,实际就是证明剩余固体中没有Cu和C,只有CuO,所以操作步骤、现象和结论:取玻璃管内固体加入稀硫酸,若固体全都溶解得到蓝色溶液,则固体在通入氧气后完全发生反应
考点:实验室制取气体装置的选择及制取氢气的原理,碳、铜、氧化铜的化学性质

(5分)我们学习了常见气体的实验室制法,知道了制取气体的一般思路和方法。
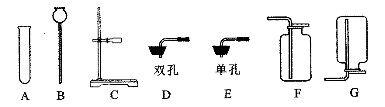
(1)实验室制取气体时,确定发生装置需要考虑的因素有 (填字母序号)。
| A.反应物的状态 | B.气体的密度 |
| C.反应的条件 | D.气体的溶解性 |

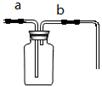
仪器a的名称是 。
高锰酸钾制取氧气选用的发生装置是 (填字母序号);用装置C收集二氧化碳的原因是 。
③常温下碳化钙固体与水反应可以制得乙炔气体,已知乙炔的密度与空气接近且难溶于水。实验室欲制取乙炔,选择的装置是 (填字母序号)。
(7分)根据下列装置图,按要求回答有关问题。
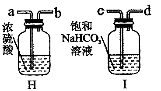
(1)写出图中带有标号仪器的名称:a ,b 。
(2)实验室制取二氧化碳,检验二氧化碳已收集满的方法是 。
(3)实验室用加热氯酸钾和二氧化锰混合物的方法制取并收集较干燥的氧气时,应选用的装置
是 (填序号),反应的化学方程式为 ;若实验室用加热高锰酸钾的方法制取并用排水法收集氧气,当收集完毕后,应先将导管移出水面,然后再 。
(4)实验室还可以用分解过氧化氢溶液的方法制取氧气。常温下,在试管中分别加入下列物质,把带火星的木条伸入试管,不能使木条复燃的是 (填字母代号)。
| A.5mL5%的过氧化氢溶液 | B.5mL5%的过氧化氢溶液和少量二氧化锰 |
| C.5mL5%的过氧化氢溶液和少量硫酸铜溶液 | D.5mL5%的过氧化氢溶液和少量红砖粉末 |