题目内容
【题目】⑴从海水中提取食盐的方法主要为盐田法,这是一种古老而至今仍广泛沿用的方法。海水晒盐的流程如下:
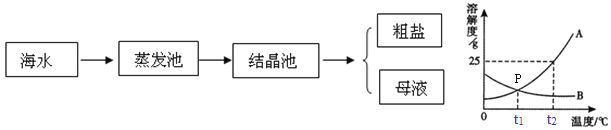
(1)海水晒盐后得到的母液是当时温度下氯化钠的________________溶液(填“饱和”或“不饱和”)。
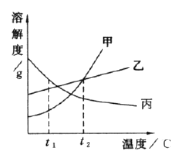
(2)如图是A、B两种物质的溶解度曲线,回答下列问题:
①t2℃时,A的饱和溶液中溶质的质量分数为________________。t2℃时,若将50gA配成饱和溶液,至少加水________________g。
②若A物质中含有少量B物质,可用____________的方法提纯A(选填“降温结晶”、“蒸发结晶”之一)。
③将t2℃时B的饱和溶液降低温度,溶液中溶质的质量分数__________(填“变大”、“变小”或“不变”)。
【答案】 饱和 20% 200 降温结晶 不变
【解析】(1). 饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。析出晶体后的溶液为饱和溶液,所以海水晒盐后得到的母液是当时温度下氯化钠的饱和 (2). 饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%,t2℃时,A的溶解度为25g,其饱和溶液中溶质的质量分数为 25g÷(25g+100g)×100%=20% (3). 若将50gA配成饱和溶液,至少加水的质量为x,(50g+x)×20%=50g x=200g; (4). A的溶解度受温度较大,随温度的降低而减小,B的溶解度受温度很小,若A物质中含有少量B物质,可用降温结晶的方法提纯A (5). B的溶解度随温度的降低而升高,将t2℃时B的饱和溶液降低温度溶质质量不变,,溶液中溶质的质量分数不变

【题目】某石油化工厂化验室的实验员用20%的氢氧化钠溶液洗涤一定量石油产品中的残余稀硫酸,测得实验数据如表:
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30g | pH<7 |
② | 40g | pH=7 |
③ | 50g | pH>7 |
请回答下列问题:
(1)欲计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号 的数据。
(2)当PH》7时,溶液中的溶质是 。
(3)若一定量石油产品中残余稀硫酸的质量为100g,请计算该残余稀硫酸的溶质质量分数。(写 出详细的计算过程)