题目内容
如图是实验室常见的制取气体的装置,请结合下图回答问题: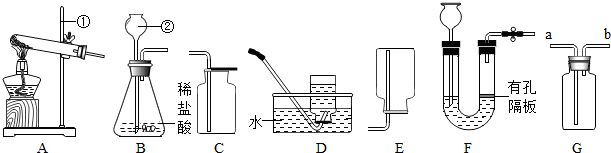
(1)标号②的仪器名称: .
(2)若用高锰酸钾制取氧气,应选用的发生装置是 (填字母);写出该反应化学方程式 ,在用胶皮管连接收集装置D中的玻璃导管时,应先把玻璃管口 ,然后稍稍用力把玻璃管插入胶皮管.某同学发现水槽中的水变成了浅紫红色,从实验操作角度分析其原因是 .
(3)若要制取二氧化碳,选用的块状固体药品为 ;选择发生装置B和收集装置 (选填序号)可以用于实验室制取CO2,若将发生装置由B改为F,其优点是 .
(4)实验室可用(NH4)2SO4固体和熟石灰混合加热制取氨气,应选择发生装置为 (选填序号).若选用G装置代替E装置收集氨气,气体应从 (填“a”或“b”)导管口通入.

(1)标号②的仪器名称:
(2)若用高锰酸钾制取氧气,应选用的发生装置是
(3)若要制取二氧化碳,选用的块状固体药品为
(4)实验室可用(NH4)2SO4固体和熟石灰混合加热制取氨气,应选择发生装置为
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,制取氧气的操作步骤和注意点,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)实验室利用高锰酸钾制取氧气时,属于固体加热型反应;高锰酸钾加热生成锰酸钾、二氧化锰和氧气;在用胶皮管连接玻璃导管时,为便于插入,应增加润滑程度;为防止高锰酸钾进入了水槽,应在A装置中试管口放一团棉花;
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙;不同的实验装置,功能不同;
(4)根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置和收集装置;
(2)实验室利用高锰酸钾制取氧气时,属于固体加热型反应;高锰酸钾加热生成锰酸钾、二氧化锰和氧气;在用胶皮管连接玻璃导管时,为便于插入,应增加润滑程度;为防止高锰酸钾进入了水槽,应在A装置中试管口放一团棉花;
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙;不同的实验装置,功能不同;
(4)根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置和收集装置;
解答:解:
(1)②是长颈漏斗.
故填:长颈漏斗.
(2)实验室利用高锰酸钾制取氧气时,属于固体加热型反应,应选用的发生装置是A;高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的方程式是:2KMnO4
K2MnO4+MnO2+2O2↑;在用胶皮管连接收集装置D中的玻璃导管时,为增加润滑程度,应先把玻璃管口用水湿润,若某同学发现水槽中的水变成了浅紫红色,那是因为有高锰酸钾进入了水槽,从实验操作角度分析其原因是:没有在A装置中试管口放一团棉花;
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,选择发生装置B和收集装置C可以用于实验室制取CO2,若将发生装置由B改为F,其优点是能够随时控制反应的进行或停止.
(4)实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3,属于固体加热型,应选择发生装置为A装置.若选用G装置代替E装置收集氨气,因为氨气的密度比空气小,气体应从b导管口通入.
故答案为:
(1)长颈漏斗;
(2)A; 2KMnO4
K2MnO4+MnO2+O2↑;用水湿润;没有在A装置中试管口放一团棉花;
(3)大理石或石灰石;C;能控制反应发生和停止;
(4)A;b.
(1)②是长颈漏斗.
故填:长颈漏斗.
(2)实验室利用高锰酸钾制取氧气时,属于固体加热型反应,应选用的发生装置是A;高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的方程式是:2KMnO4
| ||
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,选择发生装置B和收集装置C可以用于实验室制取CO2,若将发生装置由B改为F,其优点是能够随时控制反应的进行或停止.
(4)实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3,属于固体加热型,应选择发生装置为A装置.若选用G装置代替E装置收集氨气,因为氨气的密度比空气小,气体应从b导管口通入.
故答案为:
(1)长颈漏斗;
(2)A; 2KMnO4
| ||
(3)大理石或石灰石;C;能控制反应发生和停止;
(4)A;b.
点评:本题综合考查了学生的基本实验能力,涉及仪器的名称、化学方程式的书写、装置选择、实验基本操作等知识,只有综合理解化学知识才能够正确的解答.

练习册系列答案
相关题目
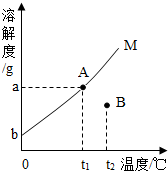 根据固体物质M在水中的溶解度曲线图,回答下列问题:
根据固体物质M在水中的溶解度曲线图,回答下列问题: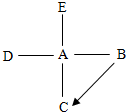 A、B、C、D、E均为初中化学中不同类别的物质,它们的变化关系如图所示,(1)自然界中为了防止B→C的发生可以采取的措施是
A、B、C、D、E均为初中化学中不同类别的物质,它们的变化关系如图所示,(1)自然界中为了防止B→C的发生可以采取的措施是 某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究: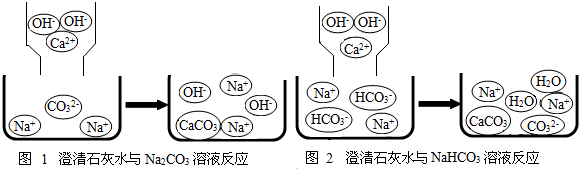
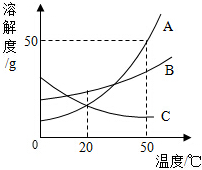 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.