题目内容
根据金属活动性顺序分析,下列描述或判断错误的是( )
分析:金属镁、铁、铜、银、锌的活动性由强到弱的顺序为:镁>锌>铁>铜>银;金属活动性越强,反应速率越快;金属与盐溶液反应时,活动性强的金属都能把活动性弱的金属从其盐溶液中置换出来,据此分析解答;
解答:解:A、由于锌的活动性比铁强,所以与同种盐酸反应时,面积相同的锌片比铁片反应剧烈;
B、在氧气中灼烧时,铁丝会剧烈反应生成四氧化三铁,而铜丝反应不剧烈不能燃烧;
C、铜虽然活动性不强,但其活动性比银强,可以从银的可溶性盐如硝酸银溶液中置换出银,故D错误;
D、由于镁的金属活动性比铁强,所以常温下,在空气中金属镁比铁容易氧化;
故选C
B、在氧气中灼烧时,铁丝会剧烈反应生成四氧化三铁,而铜丝反应不剧烈不能燃烧;
C、铜虽然活动性不强,但其活动性比银强,可以从银的可溶性盐如硝酸银溶液中置换出银,故D错误;
D、由于镁的金属活动性比铁强,所以常温下,在空气中金属镁比铁容易氧化;
故选C
点评:本题难度不大,主要考查了对金属活动性顺序的应用,从而培养学生对所学知识的灵活应用.

练习册系列答案
相关题目
(11分)我们生活在“水球”上,地球表面的70.8%被水覆盖。
(1)海水晒盐是借助日光和风力使海水中的 ▲ (写化学式)蒸发,得到含有较多杂质的 ▲ (写化学式)晶体。
(2)降雨是自然界中水循环的一个环节。 ▲ 气体 或这些气体在空气中反应后的生成物溶于雨水,会 ’ 形成酸雨。A、B、C三个地区雨水的pH如右图所 不,其中 ▲ 地区的雨水是酸雨。
(3)请按要求写出初中化学教材中水作为反应物的化学 方程式(两个化合反应中生成物的类别必须不同):‘
①分解反应: ▲
②化合反应: ▲
③化合反应: ▲ 
(4)下表提供了在一定条件下.水能否与一些金属发生反应的信息·
①请根据金属活动性顺序和表中的已知信息,将表格填写完整。
| 物质 | 钠与冷水 | 镁与冷水 | 镁与水蒸汽 | 铁与冷水 | 铁与水蒸气 |
| 能否发生反应 | 剧烈反应 | 缓慢反应 | ▲  | 不反应 | 加热条件下能反应 |
③铁虽然常温下与水不反应,但铁制品在潮湿的环境中容易生锈。某同学进行了如右图所示实验。一周以后发现铁钉表面锈蚀。图中a、b、c三处锈蚀情况最严重的是 ▲ (填字母),产生该现象的原因是 ▲

根据金属活动性顺序的相关知识,回答下列问题.
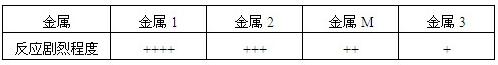
(1)将某金属M加入稀硫酸中,观察到金属M表面有气泡产生,M在金属活动性顺序表中的位置是在氢的 .
(2)在相同条件下,把金属M及另外三种金属分别加入同浓度、等体积的稀硫酸中,观察反应产生气泡的剧烈程度,并记录如下(反应剧烈程度用“+”的多少表示):
如果上述四种金属分别是Al、Mg、Fe、Zn,你认为金属M是 .
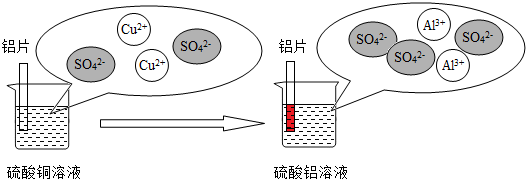
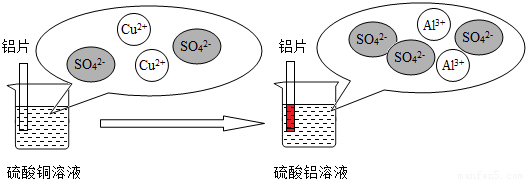
(3)铝和硫酸铜溶液反应的过程如下图所示:
上述反应的化学方程式是 ,从微观粒子变化的角度分析铝片在硫酸铜溶液中发生的变化 .
(4)向硝酸银和硝酸铜的混合液中加入一些镁粉,充分反应后过滤.若向滤渣中滴加稀盐酸后没有气泡产生,则下列说法正确的是 (填字母序号).
A.滤渣中可能含有铜,滤液中一定含有硝酸镁
B.滤渣中可能含有银,滤液中一定没有硝酸铜
C.滤渣中可能含有镁,滤液中可能含有硝酸银
D.滤渣中一定含有银,滤液中可能含有硝酸银
(1)将某金属M加入稀硫酸中,观察到金属M表面有气泡产生,M在金属活动性顺序表中的位置是在氢的 .
(2)在相同条件下,把金属M及另外三种金属分别加入同浓度、等体积的稀硫酸中,观察反应产生气泡的剧烈程度,并记录如下(反应剧烈程度用“+”的多少表示):
| 金属 | 金属1 | 金属2 | 金属M | 金属3 |
| 反应剧烈程度 | ++++ | +++ | ++ | + |
(3)铝和硫酸铜溶液反应的过程如下图所示:
上述反应的化学方程式是 ,从微观粒子变化的角度分析铝片在硫酸铜溶液中发生的变化 .
(4)向硝酸银和硝酸铜的混合液中加入一些镁粉,充分反应后过滤.若向滤渣中滴加稀盐酸后没有气泡产生,则下列说法正确的是 (填字母序号).
A.滤渣中可能含有铜,滤液中一定含有硝酸镁
B.滤渣中可能含有银,滤液中一定没有硝酸铜
C.滤渣中可能含有镁,滤液中可能含有硝酸银
D.滤渣中一定含有银,滤液中可能含有硝酸银


 金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题:
金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题: