题目内容
【题目】在做“铁与硫酸铜溶液反应来验证质量守恒定律”实验时,除观察到铁钉表面有红色物质析出外,还看到有较多的气泡产生.为确定气体成分,进行下列实验探究:
[提出问题]生成的气体是什么呢?
[猜想与假设]从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种
[查阅资料]SO2是一种有毒气体,不能燃烧,能使红色的品红溶液变为无色,H2、O2都不能使红色品红溶液褪色,但H2能燃烧,O2能支持燃烧.
[设计与实验]
(1)甲同学为确定是否含有SO2,他将气体通入红色的品红溶液中,溶液颜色未发生变化,则该气体中 SO2(填“有”或“无”).
(2)乙同学认为只有O2,则可用 来检验.实验证明乙同学的观点不正确.
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知:O2+4KI+4HCl═2I2+4KCl+2H2O,I2为碘单质,遇淀粉溶液变蓝.于是他设计了如下的实验装置:
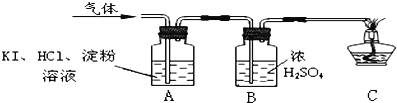
[实验现象与结论]A中观察到 ,证明不含O2;
C中导管口观察到 ,证明该气体是H2,
该反应的化学方程式为 .
[反思与评价]:
(4)大家认为丙同学在点燃导管口的气体之前,应对气体先 以确保安全.
(5)由上述实验可知,硫酸铜溶液显 性(填“酸”或“碱”).
【答案】(1)无;(2)带火星的木条;
(3)不变色;气体燃烧;2H2+O2![]() 2H2O;
2H2O;
(4)验纯;(5)酸.
【解析】(1)将气体通入红色的品红溶液中,溶液颜色未发生变化,说明该气体中不含有二氧化硫,故填:无;
(2)检验氧气可以使用带火星的木条,故填:带火星的木条;
(3)根据O2+4KI+4HCl═2I2+4KCl+2H2O,没有氧气,则不会生成碘单质,则A中溶液不会变蓝,氢气具有可燃性,C中管口观察到气体燃烧,说明含有氢气,氢气燃烧生成的是水,故填:不变色,气体燃烧,2H2+O2![]() 2H2O;
2H2O;
(4)可燃性气体不纯时点燃或加热会产生爆炸,因此点燃前要检验气体的纯度,故填:验纯;
(5)硫酸铜溶液与铁混合能产生氢气,说明硫酸铜溶液呈酸性,故填:酸.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学反应的程度与反应物的浓度之间有一定的规律可循.某实验小组各取等量的木炭和等质量的硫分别在容积相同的集气瓶中燃烧.记录如表:
实验 | 实验步骤 | 实验现象 | 燃烧反应的文字表达式 | ||
A | ①木炭在空气中燃烧 | ①木炭红热 | 产生的气体都能使澄清石灰水变浑浊 | ||
②木炭在氧气中燃烧 | ② | ||||
B | ③硫在空气中燃烧 | ③微弱的淡蓝色火焰 | 产生的气体都有刺激性气味 | ||
④硫在氧气中燃烧 | ④ | ||||
通过A、B两组对比实验的现象,可以得出的规律是: .

