题目内容
【题目】研究物质的溶解对于生产、生活有重要意义。
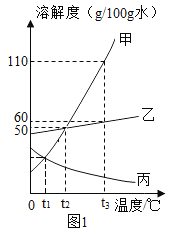
(1)图 1 为甲、乙、丙(均不含结晶水)三种固体物质的溶解度曲线。t3℃,甲物质的溶解度是_____克/100g 水,把丙的饱和溶液转化为不饱和溶液的一种方法是_____。
(2)t1℃,在一定量水中依次进行如图2实验,得到相应的溶液 a~c。
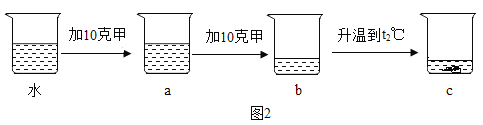
溶液 a~c 中,一定属于不饱和溶液的是_____(填编号);
溶液 a~c 中,溶质质量分数大小关系为_____(用“>”“<”“=”连接)。
(3)t1℃,把 120g 甲和 100g 乙的饱和溶液分别恒温蒸发 10g 水,析出晶体的质量关系是_____。
A 甲>乙 B 甲<乙 C 甲=乙 D 无法确定
(4)t2℃,30 克甲物质放入盛有 50 克水烧杯中,得到溶液_____克;对该烧杯进行如下实验,一定能 使该烧杯中溶质质量分数发生改变的是_____。
A 加入甲物质 B 升温 C 降温 D 加少量水
【答案】110 降温或加溶剂 ac b=c>a B 75 BC
【解析】
(1)由图1可知,t3℃,甲物质的溶解度是110g/100g;由图可知丙的溶解度随温度的升高而减小,所以把丙的饱和溶液转化为不饱和溶液的一种方法是降温或加溶剂;
(2)甲的溶解度随温度的升高而增大,由图2可以看出b溶液中无固体,说明b可能是不饱和溶液,也可能是恰好饱和,所以a溶液肯定是不饱和溶液,c溶液为升温得到,所以c溶液肯定是不饱和溶液,故溶液 a~c 中,一定属于不饱和溶液的是:ac;
a溶液中溶有10g甲,bc溶液中均溶有20g甲,所以溶液 a~c 中,溶质质量分数大小关系为:b=c>a;
(3)t1℃,把 120g 甲和 100g 乙的饱和溶液分别恒温蒸发 10g 水,比较析出晶体的质量,即比较10g水溶解甲乙的质量,t1℃时甲的溶解度小于乙的溶解度,所以析出晶体的质量甲<乙;故选:B。
(4)t2℃时甲的溶解度是50g,所以50g水能溶解25g甲物质,t2℃,30 克甲物质放入盛有 50 克水烧杯中,得到溶液为:5og+25g=75g;
A 因为此时溶液已经是饱和溶液了,且由5g固体不溶,再加入甲物质,不会再溶解,不会改变烧杯中溶液的溶质质量分数;
B 甲物质的溶解度随温度的升高而增大,所以升温可以溶解更多的甲物质,使烧杯中溶液的溶质质量分数增大;
C 降温会析出更多的甲物质,烧杯中溶液的溶质质量分数减小;
D 加少量水,如果固体全部恰好溶解或者溶解一部分,烧杯中溶液仍是该温度下的饱和溶液,溶质质量分数不变,所以加少量水不一定能改变烧杯中溶液的溶质质量分数;
故选:BC。

【题目】工业中利用如下反应合成SO3:2SO2+O2![]() 2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A. 丁物质一定是催化剂V2O5
B. 参加反应的SO2分子、O2分子的个数比为2:1
C. 丙物质是O2
D. d=15