题目内容
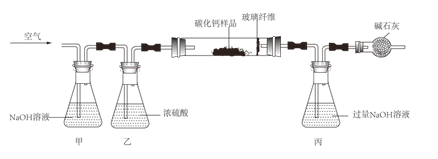
【题目】如下图为CO还原CuO“微型”实验装置(夹持仪器等略),已知: ![]() ,下列说法错误的是( )
,下列说法错误的是( )
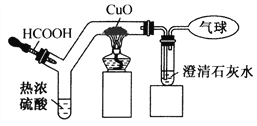
A. 实验中所需CO可现制现用
B. 此装置可节约用品,污染小,现象明显
C. 此装置内空间较小,空气易排空,实验危险系数小
D. 该实验中所涉及反应的基本类型有分解反应和置换反应
【答案】D
【解析】A、实验中所需CO可通过胶头滴管加入甲酸的方法制取,可现制现用,正确;B、此装置内空间较小,可节约用品,产生的污染污染物较少,现象明显,正确;C、此装置内空间较小,空气易排空,实验危险系数小,正确;D、甲醛在加热条件下和浓硫酸的作用下分解生成一氧化碳和水,是分解反应;一氧化碳和氧化铜反应生成铜和二氧化碳,反应物都是化合物,不是置换反应,错误。故选D。

练习册系列答案
相关题目
【题目】下列四个图像中,能正确反映对应变化关系的是
|
|
|
|
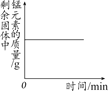
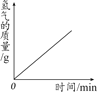
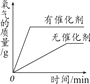
A.加热一定质量的高锰酸钾固体 | B.电解一定量的水 | C.木炭在高温下和氧化铜反应 | D.用两份完全相同的过氧化氢溶液分别制取氧气 |
A. A B. B C. C D. D