题目内容
初三(1)班学生将采集到的块状石灰石样品用水冲洗后晾干,称得样品质量为25.0g。该班甲、乙两组同学共利用这25.0g石灰石样品分别进行了如下实验。(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)
【实验过程】
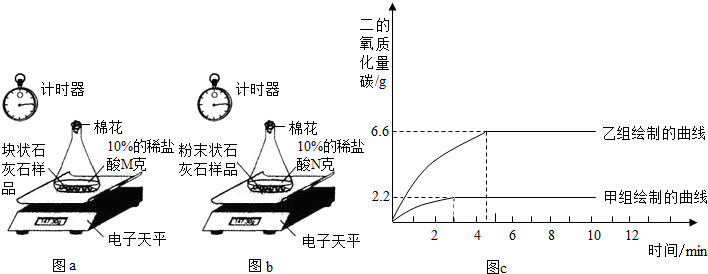
甲组:取一定质量的块状石灰石样品于锥形瓶内,加入过量的10%的稀盐酸M g,测定反应过程中锥形瓶中的药品质量变化。(如图a)
乙组:把剩余的块状石灰石样品研碎成粉末状,然后全部置于另一锥形瓶内,加入10%的稀盐酸N g,测定反应过程中锥形瓶中药品的质量变化。(如图b)
两组同学经数据处理得到释放出二氧化碳的质量与反应时间的关系。(如图c)
【实验过程】
甲组:取一定质量的块状石灰石样品于锥形瓶内,加入过量的10%的稀盐酸M g,测定反应过程中锥形瓶中的药品质量变化。(如图a)
乙组:把剩余的块状石灰石样品研碎成粉末状,然后全部置于另一锥形瓶内,加入10%的稀盐酸N g,测定反应过程中锥形瓶中药品的质量变化。(如图b)
两组同学经数据处理得到释放出二氧化碳的质量与反应时间的关系。(如图c)
【问题讨论】
(1)甲、乙两组同学的实验中,__________组实验消耗的时间更短。
(2)两次实验中消耗的稀盐酸质量比甲:乙=__________。
(3)求石灰石样品中碳酸钙的质量分数。 。
(1)甲、乙两组同学的实验中,__________组实验消耗的时间更短。
(2)两次实验中消耗的稀盐酸质量比甲:乙=__________。
(3)求石灰石样品中碳酸钙的质量分数。 。
(1)甲
(2)1:3
(3)解:设每份样品中CaCO3的质量为x
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 2.2g+6.6g
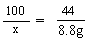 x=20g
x=20g
 ×100%=80.0%
×100%=80.0%
答:样品中CaCO3质量分数为80.0%
(2)1:3
(3)解:设每份样品中CaCO3的质量为x
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 2.2g+6.6g
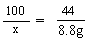 x=20g
x=20g  ×100%=80.0%
×100%=80.0% 答:样品中CaCO3质量分数为80.0%

练习册系列答案
相关题目