题目内容
【题目】美国普度大学研发出一种制备氢气的新工艺,流程如图所示。(提供信息:合金就是一种或多种金属或非金属经过混合熔融冷却后形成的一种或多种金属的混合物。)下列说法错误的是
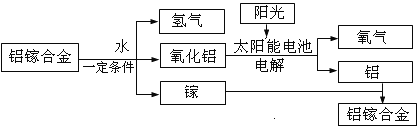
A.铝镓合金可以循环使用
B.太阳能的利用可以部分解决能源危机问题
C.流程中的氧化铝、水和氧气都属于氧化物
D.铝镓合金与水反应的符号表达式为:Al+H2O![]() Al2O3+H2
Al2O3+H2
【答案】C
【解析】
A、观察流程图发现开始的反应物是铝镓合金,最终的生成物是铝镓合金,所以铝镓合金能循环使用,不符合题意;
B、太阳能的利用可以部分解决能源危机问题,不符合题意;
C、流程中的氧化铝、水都是由两种元素组成且含有氧元素的化合物,属于氧化物,而氧气属于单质,符合题意;
D、铝镓合金与水的反应中生成物是氧化铝、氢气和镓,相当于镓未参加反应,所以实际上发生的反应是:Al+H2O![]() Al2O3+H2,不符合题意。故选C。
Al2O3+H2,不符合题意。故选C。

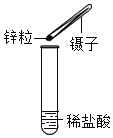
【题目】(一)小明在实验室观察完品红扩散实验后,想把变红的水做一个简单的处理后再排入下水道。请根据如图相关信息,回答下列问题:
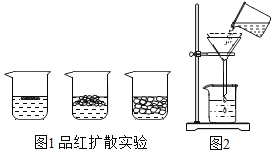
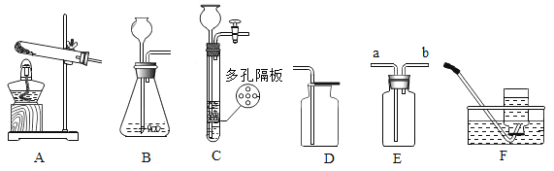
(1)图2过滤操作中必须用到的玻璃仪器分别是______、______、烧杯,请指出该操作过程中的其中两处错误______、______。
(2)小明同学将红色液体按过滤的正确操作完成后,发现过滤后的液体中仍有少量品红固体,则造成这种情况可能的原因是(填一种即可)______
(3)水是一种重要的资源,人类离不开水。在很长一段时期内,人类不了解水到底是由什么组成的。直到18世纪末,人类通过电解水实验才最终认识了水的组成。下列实验也能证明水是由氧元素和氢元素组成的是______(填序号)
A 氢气在氧气中燃烧 B 石蜡在空气中燃烧 C 水的蒸发 D 水的净化
(二)实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:______。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
(完成实验)按下表进行试验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比l:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验______形成对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是______。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和______;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证______。
【题目】催化剂在化学反应中起着非常重要的作用,某兴趣小组进行如下探究。
探究一 催化剂的选择
研究表明,许多金属氧化物对氯酸钾有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如表所示:
温度 | Fe2O3 | Al2O3 | CuO | MgO |
开始反应 | 470 | 515 | 305 | 490 |
剧烈反应 | 490 | 540 | 350 | 545 |
(1)上述实验中,从温度对反应催化效果来看,最好选用__________作催化剂。
探究二 氧化铜与二氧化锰的催化效果进行比较
用如图装置进行实验,实验均以生成25mL气体为准,可能影响实验的因素均已忽略,相关装置和数据见下表:
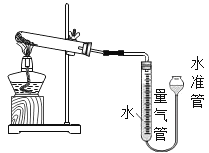
序号 | KClO3质量 | 催化剂质量 | 待测试剂 |
① | 2.45g | — | a |
② | 2.45g | 0.51gMnO2 | b |
③ | 2.45g | 0.51gCuO | c |
(2)上述实验中的“待测数据”是________________。若b_________c(填“>”、“=”或“<”)可知在某温度下氧化铜对氯酸钾分解效果更好。
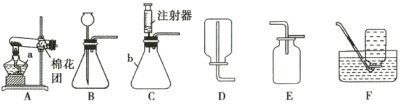
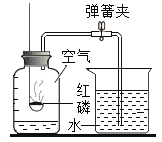
探究三 氧化铜与二氧化锰的对于过氧化氢的催化效果进行比较
安妮同学用如图1所示的装置进行了两次实验,在试管中分别加入等质量的氧化铜和二氧化锰,分别将注射器内盛有的双氧水注入试管中,利用注射器收集氧气,收集到氧气的体积和时间的关系如图2所示。
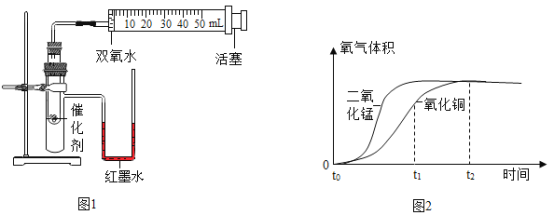
(3)装入药品前检查该装置气密性的方法是_____________,开始实验时注入双氧水的方法是________(填序号),另一种方法除了误差较大,还可能造成的后果是_____________。
A快速推注射器活塞 B缓慢推注射器活塞
(4)实验中造成U形管内红墨水液面左低右高的可能原因是_____________。
(5)通过图象2除了能得出二氧化锰催化效果比氧化铜好,还能得出的结论是________________。
(6)由氧化铜催化的反应,t1-t2时间段反应速率逐渐变_______(填“快”或“慢”),原因是___________________。