题目内容
【题目】下图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:
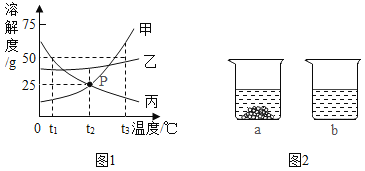
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是_________。
(2)P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为_____。
(3)t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,
则烧杯a中溶解的物质是________(填“甲”或‘‘乙”),所得溶液的质量为______g。
(4)当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用______(填(“降温”或“蒸发”)结晶的方法提纯甲物质。
(5)下列说法正确的是____(填字母序号)。
A 将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
B 将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质最分数增大
C 将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙
D 将t3℃三种物质的饱和溶液降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
【答案】丙>乙>甲 1:4 甲 50g 降温 C
【解析】
(1)由溶解度曲线可知,t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:丙>乙>甲;
(2) 由溶解度曲线可知,P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为25g:100g=1:4;
(3) 由溶解度曲线可知, t2℃时,甲的溶解度小于乙的溶解度,且甲的溶解度为25g。故t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,
则烧杯a中溶解的物质是甲,40g水中溶解甲的质量为:25g×40g÷100g=10g,故所得溶液的质量为40g+10g=50g;
(4) 由溶解度曲线可知,甲的溶解度随温度的升高而增大且受温度的影响较大,故可采用降温结晶的方法提纯甲物质;
(5)A、甲物质的溶液是否饱和,不能确定,故将甲物质的溶液由t3℃降温到t2℃,不一定有晶体析出,错误;
B、将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质、溶剂的质量均不改变,溶液的质量也不改变,故其溶质质最分数不变,错误;
C、t3℃时三种物质的溶解度大小关系是甲>乙>丙,故将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙,正确;
D、由溶解度曲线可知,t3℃时三种物质的溶解度大小关系是甲>乙>丙,t2℃时三种物质的溶解度大小关系是乙>甲=丙,将t3℃三种物质的饱和溶液降温至t2℃,甲、乙有晶体析出,且甲析出晶体的质量大于乙,溶质质量分数乙>甲,丙无晶体析出,溶质质量分数不变,故所得溶液的溶质质量分数:乙>甲>丙。
故选C。