题目内容
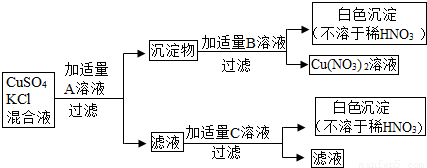
31、某同学欲把CuSO4和KCl的混合液中的SO42-和Cl-分别转化成沉淀.他采用了下图所示的实验步骤进行操作:

根据图示的步骤和现象确定该同学所用的试剂:
A为
(2)写出加入适量A的反应化学方程式:

根据图示的步骤和现象确定该同学所用的试剂:
A为
Ba(OH)2
溶液;B为HNO3
溶液;C为AgNO3
溶液.(2)写出加入适量A的反应化学方程式:
CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓
.分析:解答此题可根据离子的性质和框图表示的物质间的反应关系来分析,已知SO42-和Ba2+能结合成硫酸钡沉淀,Cl-和Ag+能结合成氯化银沉淀,且沉淀都不溶于水和稀硝酸;可从Cu(NO)3作为突破口依次推断分析.
解答:解:把混合液中的SO42-和Cl-分别转化成沉淀需要Ba2+和Ag+,后面生成的不溶于稀硝酸的白色沉淀分别是硫酸钡和氯化银;因为硫酸银是微溶于水的,故不能先加硝酸银溶液,应先加钡离子把硫酸根沉淀出来,根据后面生成的Cu(NO)3来看,B物质应该是硝酸,沉淀物中含有硫酸钡和氢氧化铜,由此分析加入的A物质是Ba(OH)2,C物质是AgNO3;
故答案为:(1)A:Ba(OH)2 B:HNO3 C:AgNO3 (2)CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓
故答案为:(1)A:Ba(OH)2 B:HNO3 C:AgNO3 (2)CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓
点评:除去一种物质中的多种杂质时,首先根据物质的性质选择适当的试剂,然后确定加入除杂剂顺序,要避免反应间的相互干扰.此题难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某同学欲检验NaOH粉末中是否混有Na2CO3,他设计了三个实验方案如下:
| 方案 | 结论 | 你对实验方法和结论的评价 | |
| 方案1 | 样品溶于蒸馏水,把pH试纸投入溶液中,若pH大于7 | 混有Na2CO3 | ________ |
| 方案2 | 取少量样品溶于蒸馏水后滴入CuSO4溶液,有蓝色沉淀出现 | 混有Na2CO3 | ________ |
| 方案3 | 取少量样品溶于蒸馏水后滴入足量BaCl2溶液,有白色沉淀 | 混有Na2CO3 | ________ |
某同学欲检验NaOH粉末中是否混有Na2CO3,他设计了三个实验方案如下:
| 方案 | 结论 | 你对实验方法和结论的评价 | |
| 方案1 | 样品溶于蒸馏水,把pH试纸投入溶液中,若pH大于7 | 混有Na2CO3 | ______ |
| 方案2 | 取少量样品溶于蒸馏水后滴入CuSO4溶液,有蓝色沉淀出现 | 混有Na2CO3 | ______ |
| 方案3 | 取少量样品溶于蒸馏水后滴入足量BaCl2溶液,有白色沉淀 | 混有Na2CO3 | ______ |