题目内容
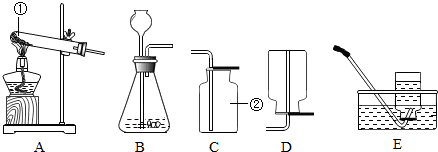
 下面是实验室制取氧气的装置图,根据装置图回答下列问题:
下面是实验室制取氧气的装置图,根据装置图回答下列问题:(1)写出装置图中标有①②序号的仪器名称:①
试管
试管
;②酒精灯
酒精灯
.(2)实验室用氯酸钾制取氧气时的化学表达式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
,可选用的发生装置是
| ||
| △ |
A
A
;可选用的收集装置是C
C
和D
D
.(3)装置B是实验室用
过氧化氢
过氧化氢
和二氧化锰
二氧化锰
制取氧气的发生装置.(4)用加热高锰酸钾制取氧气时,常在试管口放一团
防止高锰酸钾粉末进入导管
防止高锰酸钾粉末进入导管
,反应的化学表达式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(5)用D装置收集氧气的依据是
氧气的密度略大于空气的密度
氧气的密度略大于空气的密度
,用该方法收集氧气时,检验氧气是否集满的方法是将带火星的木条伸入瓶口处,若木条复燃,则证明氧气收集满了
将带火星的木条伸入瓶口处,若木条复燃,则证明氧气收集满了
.(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下NH3是一种无色、有刺激性气味的气体,密度比空气小.NH3极易溶于水,其水溶液呈碱性.实验室制取并收集NH3,应该从上图中选择的装置是
AE
AE
.(7)若用如图所示装置有多种用途,①收集氨气时,氨气应从
b
b
管口通入瓶中;②若将瓶中装满水,收集氢气或氧气时,气体应从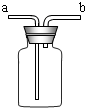
b
b
管口通入瓶中;③若将瓶中装入半瓶蒸馏水可用于病人输送装置,a
a
端连接贮氧气钢瓶,在输送的过程中,这一装置能起到的作用是观察是否有氧气输出
观察是否有氧气输出
、观察氧气的流速
观察氧气的流速
、湿润氧气
湿润氧气
.[拓展探究]
学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如Al2O3是否也可作过氧化氢分解的催化剂.请你一起参与他们的探究过程,并填写下列空白.
[提出问题]Al2O3能不能作过氧化氢分解的催化剂呢?
[作出猜想]Al2O3能作过氧化氢分解的催化剂.
[实验验证]
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 将带火星的木条伸入装有过氧化氢溶液的试管中 |
有少量气泡 木条不复燃 |
常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡木条复燃 | 加入Al2O3能加快过氧化氢溶液的分解速率 加入Al2O3能加快过氧化氢溶液的分解速率 |
[反思提高]经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
[实验目的]探究
Al2O3在反应前后质量是否改变
Al2O3在反应前后质量是否改变
.[实验步骤]①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,
干燥
干燥
,称量;④对比反应前后Al2O3的质量.[交流讨论]如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
[提出新的问题]但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究
Al2O3的化学性质在反应前后是否改变
Al2O3的化学性质在反应前后是否改变
.分析:(1)熟悉常用仪器的名称和用途;
(2)根据氯酸钾与二氧化锰制取氧气的反应写出反应的方程式.根据氯酸钾与二氧化锰制取氧气的反应写出反应的方程式.根据反应物的状态及反应条件确定发生装置,根据收集方法确定收集装置;
(3)分析装置特点,选择药品制取氧气;
(4)根据用高锰酸钾制取氧气的反应及注意的事项分析;
(5)根据D装置的特点分析确定收集装置的依据,根据氧气的性质分析验满的方法;
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,根据反应物的状态及反应条件确定发生装置,根据收集方法确定收集装置;
(7)根据气体的密度与空气、水的密度关系分析进气口,出气口;
[拓展探究]要探究一种物质能否作为化学反应的催化剂,一般要注意从三个方面入手进行:一是探究加入该物质能否改变化学反应速率;二是探究反应前后该物质的质量是否改变;三是探究化学反应前后该物质的化学性质是否改变.
(2)根据氯酸钾与二氧化锰制取氧气的反应写出反应的方程式.根据氯酸钾与二氧化锰制取氧气的反应写出反应的方程式.根据反应物的状态及反应条件确定发生装置,根据收集方法确定收集装置;
(3)分析装置特点,选择药品制取氧气;
(4)根据用高锰酸钾制取氧气的反应及注意的事项分析;
(5)根据D装置的特点分析确定收集装置的依据,根据氧气的性质分析验满的方法;
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,根据反应物的状态及反应条件确定发生装置,根据收集方法确定收集装置;
(7)根据气体的密度与空气、水的密度关系分析进气口,出气口;
[拓展探究]要探究一种物质能否作为化学反应的催化剂,一般要注意从三个方面入手进行:一是探究加入该物质能否改变化学反应速率;二是探究反应前后该物质的质量是否改变;三是探究化学反应前后该物质的化学性质是否改变.
解答:解:(1)图中标号仪器的名称是:①是试管,②酒精灯;
(2)用氯酸钾与二氧化锰制取氧气,同时生了氯化钾,反应的化学方程是:2KClO3
2KCl+3O2↑,属于加热固体制取气体,可用A作发生装置,由于氧气谜底比空气略大,不易溶于水,可用C或D装置收集;
(3)B装置属于固液常温下反应制取氧气,可用过氧化氢和二氧化锰制取氧气;
(4)用加热高锰酸钾制取氧气时,常在试管口放一团防止高锰酸钾粉末进入导管,反应的化学表达式为:2KMnO4
K2MnO4+MnO2+O2↑;
(5)能用D装置向上排空气法收集氧气,是由于氧气的密度略大于空气的密度.由于氧气能支持燃烧.所以,用排空气法收集的氧气验满方法是:将带火星的木条伸入瓶口处,若木条复燃,则证明氧气收集满了;
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,属于加热固体制取气体,应用A装置作发生装置,由于氨气密度比空气小.NH3极易溶于水,只能用向下排空气法收集氨气,应用E装置收集氨气;
(7)①由于氨气的密度小于空气的密度,用该装置收集氨气时,氨气应从b端进入瓶中;②若将瓶中装满水,收集氢气或氧气时,由于氢气和氧气的密度小于水的密度,气体应从b管口通入瓶中;③若将瓶中装入半瓶蒸馏水可用于病人输送装置,a端连接贮氧气钢瓶,在输送的过程中,这一装置能起到的作用是观察是否有氧气输出、观察氧气的流速、湿润氧气.
[实验验证]
实验一的步骤是:将带火星的木条伸入装有过氧化氢溶液的试管中,带火星的木条不复燃,可见常温下过氧化氢分解速率很慢;
实验二、在装有过氧化氢溶液的试管中加入少量Al2O3,带火星的木条复燃,可见,Al2O3能加快过氧化氢的分解速率;
实验三:
[实验目的]由催化剂的定义可知,还要探究Al2O3在反应前后质量是否改变;
[实验步骤]①通过实验前后两次称量,可知实验三是探究Al2O3在反应前后质量是否改变.将实验二反应后的物质进行过滤可得到Al2O3,必须经过洗涤、烘干后才称量,减少实验数据的误差;
[提出新的问题]根据催化剂的定义,还必须在增加一个实验:探究Al2O3的化学性质在反应后是否改变.只有Al2O3具备既能改变化学反应速率,其质量和化学性质在反应前后又保持不变,才能作为过氧化氢分解的催化剂.
故答案是:(1)①是试管,②酒精灯;(2)2KClO3
2KCl+3O2↑,A,C,D;(3)过氧化氢,二氧化锰;(4)防止高锰酸钾粉末进入导管,2KMnO4
K2MnO4+MnO2+O2↑;(5)氧气的密度略大于空气的密度.将带火星的木条伸入瓶口处,若木条复燃,则证明氧气收集满了;(6)AE;(7)b,b,a,观察是否有氧气输出、观察氧气的流速、湿润氧气.
[实验验证]
实验三:[实验目的]探究Al2O3在反应前后质量是否改变;实验步骤]干燥;(5)Al2O3在反应前后质量是否改变;干燥[提出新的问题]Al2O3的化学性质在反应前后是否改变.
(2)用氯酸钾与二氧化锰制取氧气,同时生了氯化钾,反应的化学方程是:2KClO3
| ||
| △ |
(3)B装置属于固液常温下反应制取氧气,可用过氧化氢和二氧化锰制取氧气;
(4)用加热高锰酸钾制取氧气时,常在试管口放一团防止高锰酸钾粉末进入导管,反应的化学表达式为:2KMnO4
| ||
(5)能用D装置向上排空气法收集氧气,是由于氧气的密度略大于空气的密度.由于氧气能支持燃烧.所以,用排空气法收集的氧气验满方法是:将带火星的木条伸入瓶口处,若木条复燃,则证明氧气收集满了;
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,属于加热固体制取气体,应用A装置作发生装置,由于氨气密度比空气小.NH3极易溶于水,只能用向下排空气法收集氨气,应用E装置收集氨气;
(7)①由于氨气的密度小于空气的密度,用该装置收集氨气时,氨气应从b端进入瓶中;②若将瓶中装满水,收集氢气或氧气时,由于氢气和氧气的密度小于水的密度,气体应从b管口通入瓶中;③若将瓶中装入半瓶蒸馏水可用于病人输送装置,a端连接贮氧气钢瓶,在输送的过程中,这一装置能起到的作用是观察是否有氧气输出、观察氧气的流速、湿润氧气.
[实验验证]
实验一的步骤是:将带火星的木条伸入装有过氧化氢溶液的试管中,带火星的木条不复燃,可见常温下过氧化氢分解速率很慢;
实验二、在装有过氧化氢溶液的试管中加入少量Al2O3,带火星的木条复燃,可见,Al2O3能加快过氧化氢的分解速率;
实验三:
[实验目的]由催化剂的定义可知,还要探究Al2O3在反应前后质量是否改变;
[实验步骤]①通过实验前后两次称量,可知实验三是探究Al2O3在反应前后质量是否改变.将实验二反应后的物质进行过滤可得到Al2O3,必须经过洗涤、烘干后才称量,减少实验数据的误差;
[提出新的问题]根据催化剂的定义,还必须在增加一个实验:探究Al2O3的化学性质在反应后是否改变.只有Al2O3具备既能改变化学反应速率,其质量和化学性质在反应前后又保持不变,才能作为过氧化氢分解的催化剂.
故答案是:(1)①是试管,②酒精灯;(2)2KClO3
| ||
| △ |
| ||
[实验验证]
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | ||
| 实验一 | 加入Al2O3能加快过氧化氢溶液的分解速率 |
点评:本题的探究题是题探究Al2O3是不是过氧化氢分解反应的催化剂.中考有关催化剂的考查主要集中在催化剂的作用和探究某物质是不是过氧化氢或氯酸钾分解反应的催化剂.催化剂的特点可以概括为“一变二不变”,一变是能够改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变.要探究一种物质能否作为化学反应的催化剂,必须同时具备上述特点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目