题目内容
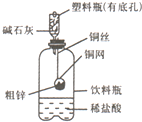 某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.请填写以下实验报告.
某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.请填写以下实验报告.(1)实验目的:
(2)实验步骤:
①称取10.0g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g.
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为
③反应完全后,称得装置总质量为119.8g,则粗锌的纯度为
考点:实验探究物质的组成成分以及含量,金属的化学性质,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:科学探究
分析:(1)根据题目信息和实验所测数据分析实验目的;
(2)根据锌和盐酸反应生成氯化锌和氢气;利用反应前后装置的质量差是氢气的质量,再利用方程式求解即可.
(2)根据锌和盐酸反应生成氯化锌和氢气;利用反应前后装置的质量差是氢气的质量,再利用方程式求解即可.
解答:解:(1)依据题目信息和实验所测数据,可知该实验是要测定粗锌样品中锌的质量分数,所以实验目的:测定粗锌样品中锌的质量分数;
(2)②锌和盐酸反应生成氯化锌和氢气,化学方程式为:Zn+2HCl=ZnCl2+H2↑;
③依据化学反应,反应前后只有氢气可以出去,因此氢气的质量=120-119.8=0.2克.
设生成0.2克氢气需要锌的质量是X.
Zn+2HCl=ZnCl2+H2↑
65 2
X 0.2g
=
,得:X=6.5g
∴粗锌的纯度=
×100%═65%.
故答案为:(1)测定粗锌样品中锌的质量分数;
(2)②Zn+2HCl═ZnCl2+H2↑;
③65%.
(2)②锌和盐酸反应生成氯化锌和氢气,化学方程式为:Zn+2HCl=ZnCl2+H2↑;
③依据化学反应,反应前后只有氢气可以出去,因此氢气的质量=120-119.8=0.2克.
设生成0.2克氢气需要锌的质量是X.
Zn+2HCl=ZnCl2+H2↑
65 2
X 0.2g
| 65 |
| X |
| 2 |
| 0.2克 |
∴粗锌的纯度=
| 6.5 |
| 10 |
故答案为:(1)测定粗锌样品中锌的质量分数;
(2)②Zn+2HCl═ZnCl2+H2↑;
③65%.
点评:该题是一道综合性较强的实验题,解题时抓住质量守恒这一主线进行了分析与探讨并进行相关计算,能很好的训练学生思维与分析问题能力.

练习册系列答案
相关题目
取用药品时,下列操作正确的是( )
| A、每取用一种药品后,都应盖好试剂瓶,标签朝外,放回原处 |
| B、若取用无腐蚀性的药品,可以用手直接拿 |
| C、用胶头滴管滴加液体时,应将滴管伸入试管中 |
| D、用药匙将粉末药品撒入试管中 |
某同学用量筒量取液体时,俯视液面读数为40mL,倒出部分液体后,仰视液面读数为20mL,则倒出的液体体积为( )
| A、大于20mL |
| B、等于20mL |
| C、小于20mL |
| D、无法判断 |





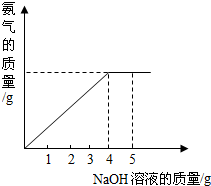 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算: 实验室里,在一个具有刻度和可以滑动的活塞的玻璃管中放入白磷(过量,白磷燃烧所需的最低温度为40℃),将玻璃管固定好,放在盛有80℃热水的烧杯上,实验装置如图所示,试回答下列问题.
实验室里,在一个具有刻度和可以滑动的活塞的玻璃管中放入白磷(过量,白磷燃烧所需的最低温度为40℃),将玻璃管固定好,放在盛有80℃热水的烧杯上,实验装置如图所示,试回答下列问题.