题目内容
【题目】复习课上,老师要求学生用不同的方法鉴别稀硫酸和氢氧化钠溶液。小东、小南两位同学取同一溶液分别进行如下实验:
【实验方案】
实验步骤 | 实验现象 | 实验结论 | |
小东 | 用玻璃棒蘸取溶液滴到pH试纸上,对照比色卡并读出pH | pH试纸变色 pH 7(填“>”或“<”) | 该溶液是氢氧化钠溶液 |
小南 | 取适量溶液于试管中,加入经打磨过的铝条 | 有气泡产生 | 该溶液是稀硫酸 |
【提出问题】为什么我们取相同溶液而实验结论却不同呢?
【解决问题】
小东、小南讨论后决定再用硫酸铜溶液进一步验证,结果观察到的现象是 ,于是一致认为该溶液是氢氧化钠溶液。为什么小南加入铝条会有气泡产生呢?通过查阅资料,他们发现初中常见金属中只有铝能与酸、碱反应,铝与氢氧化钠溶液反应的化学方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 。
【拓展延伸】利用老师要求鉴别的那两种溶液,测定镁铝铜合金中各成分的含量。实验设计如下:
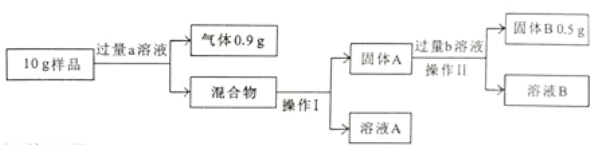
【回答问题】
(1)写出操作I中玻璃棒的作用: 。
(2)a溶液是 ,选择该溶液的理由是 。
(3)金属铜的质量为 g,固体A含有的物质是 ,溶液A中所含溶质是 。
【答案】【实验方案】>
【解决问题】有蓝色沉淀产生
【回答问题】 (1)引流
(2)氢氧化钠溶液;只有金属铝能与氢氧化钠溶液反应产生氢气,通过生成氢气质量方可求出铝质量
(3)0.5 Mg、Cu NaOH、NaAlO2
【解析】
试题分析:【实验方案】实验结论是该溶液是氢氧化钠溶液,故pH >7
【解决问题】硫酸铜溶液能与氢氧化钠溶液发生反应:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4,故观察到的现象是:有蓝色沉淀产生
【回答问题】 (1)操作I是将不溶性固体和液体分离,是过滤,故其中玻璃棒的作用:引流
(2)根据资料:常见金属中只有铝能与酸、碱反应,故a溶液是氢氧化钠溶液;选择该溶液的理由是只有金属铝能与氢氧化钠溶液反应产生氢气,通过生成氢气质量方可求出铝质量
(3)因为10g样品在加入氢氧化钠溶液后,金属铝被反应了,故固体A中含有金属镁和铜,过量的B溶液应是酸溶液,将金属镁完全反应,故固体B即为铜,所以金属铜的质量为0.5 g,固体A含有的物质是Mg、Cu;溶液A中所含溶质除了过量的氢氧化钠溶液,还有金属铝与氢氧化钠溶液反应生成的NaAlO2,故溶液A中所含溶质是:NaOH、NaAlO2