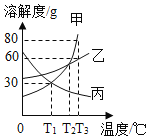
题目内容
【题目】图是实验室常用的实验装置,请回答下列问题:
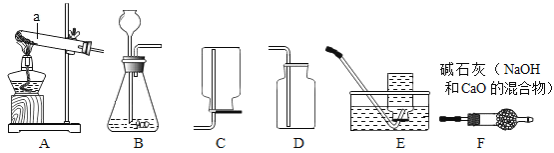
(1)仪器a的名称是 _________;
(2)实验室用氯酸钾制取并收集较纯净的氧气所选的装置是__________(填字母,下同),发生反应的化学方程式为____________ ,停止加热时应先将导管移出水面,再熄灭酒精灯,其理由是 ____________
(3)实验室常用________装置来制取并收集二氧化碳,检验二氧化碳气体常用_________(填试剂名称)溶液.
(4)已知氨气的密度比空气小,且极易溶于水,实验室常用加热氢氧化钙固体和氯化铵固体的方法制取氨气,要制取并收集干燥的氨气,所选装置的正确连接顺序是 ___________
【答案】试管 AE 2KClO3![]() 2KCl+3O2↑ 防止水倒流炸裂试管 BD 氢氧化钙 A→F→C
2KCl+3O2↑ 防止水倒流炸裂试管 BD 氢氧化钙 A→F→C
【解析】
(1)仪器a的名称是试管,故填:试管;
(2)实验室用氯酸钾制取氧气需要加热,应该用A装置作为发生装置;
因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净;
发生反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
停止加热时应先将导管移出水面,再熄灭酒精灯,其理由是防止水倒流炸裂试管;
故填:AE;2KClO3![]() 2KCl+3O2↑;防止水倒流炸裂试管;
2KCl+3O2↑;防止水倒流炸裂试管;
(3)实验室制取二氧化碳不需要加热,应该用B装置作为发生装置;
二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用D装置收集;
检验二氧化碳气体常用氢氧化钙溶液,这是因为二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水;
故填:BD;氢氧化钙;
(4)要制取并收集干燥的氨气,由于反应需要加热,应该用A装置作为发生装置,为了除去水蒸气,应该用F装置吸收水蒸气,氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用C装置收集,因此所选装置的正确连接顺序是A→F→C。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】某学习小组在实验室中看到氢氧化钠(固体)试剂瓶标签上标注着“NaOH含量不少于96.0%”,提出对氢氧化钠固体中主要含有的杂质成分进行探究。
(提出问题)氢氧化钠固体中主要含有什么杂质?
(查阅资料)工业制取NaOH的反应原理是:2NaCl + 2H2O![]() 2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
(提出猜想)氢氧化钠固体中主要杂质为Na2CO3和NaCl。
小组同学猜想含有NaCl的理由是:原料中的氯化钠没有完全转化为氢氧化钠;含有Na2CO3的理由是:___________。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
步骤①:取少量固体样品溶于水。 | 固体溶解,溶液温度明显上升 | 猜想正确 |
步骤②:待步骤①中溶液冷却后,向溶液中滴加过量_______。 | 开始无明显变化,后产生气泡 | |
步骤③:向步骤②所得溶液中滴加___________溶液。 | 产生白色沉淀 |
(实验反思)步骤②所得溶液中的溶质除NaCl外,还有______。
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如图。
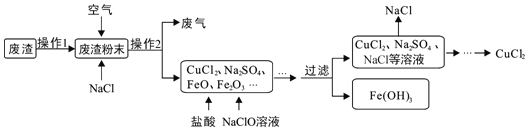
(1)废气中污染空气的气体主要是_____。
(2)在高温条件下,通入空气,CuS、NaCl等物质反应生成CuCl2和Na2SO4,该反应的化学方程式为_____。
(3)(查阅资料)不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH范围的方法,使某种金属氢氧化物沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH。
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.2 |
沉淀完全的pH | 3.2 | 6.7 |
为了只让上述流程溶液中的Fe3+完全转化为Fe(OH)3沉淀而除去,你认为调节溶液的pH到_____(填数值范围)比较合适。
(4)流程图中能循环利用的物质是_____。
(5)本流程中,铁元素的化合价除+3价外还有_____。