题目内容
有一种石灰石样品,其中含有的杂质是二氧化硅(一种不溶于水,不与盐酸反应,耐高温的固体).某学生想测定该样品的纯度,他取用2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体的质量见下表.| 稀盐酸的用量 | 第1次加入5克 | 第2次加入5克 | 第3次加入5克 | 第4次加入5克 |
| 剩余固体的质量 | 1.315克 | 0.63克 | 0.3克 | 0.3克 |
(2)石灰石样品的纯度是多少?
(3)100千克这种纯度的石灰石充分煅烧后,可得到固体多少千克?
【答案】分析:由图表分析知每加入5g盐酸会消耗0.685g固体,分析知第三次加入稀盐酸时碳酸钙已无剩余,故固体中的杂质是0.3g,利用这一量可求碳酸钙的质量分数.利用碳酸钙的质量分数求出100千克这种纯度的石灰石中碳酸钙的质量,然后求出二氧化碳的质量就可求出剩余固体的质量.
解答:解:(1)由图表分析知每加入5g盐酸会消耗0.685g固体,分析知第三次加入稀盐酸时碳酸钙已无剩余,故杂质的质量为0.3g;
(2)由图表分析知第三次剩余的固体即为杂质的量,故有:
石灰石中碳酸钙的纯度为: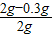 ×100%=85%
×100%=85%
答:石灰石样品的纯度是85%.
(3)设100千克这种纯度的石灰石充分煅烧后生成二氧化碳的质量为x.
CaCO3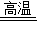 CaO+CO2↑
CaO+CO2↑
100 44
100kg×85% x

x=37.4kg
所以剩余固体的质量=100kg-37.4kg=62.6kg
答:可得到固体质量为62.6千克.
点评:此题是考查学生对图表的分析能力,并利用分析结果进行计算,关键是把握住完全反应的数据,利用有用的数据进行计算.
解答:解:(1)由图表分析知每加入5g盐酸会消耗0.685g固体,分析知第三次加入稀盐酸时碳酸钙已无剩余,故杂质的质量为0.3g;
(2)由图表分析知第三次剩余的固体即为杂质的量,故有:
石灰石中碳酸钙的纯度为:
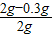 ×100%=85%
×100%=85%答:石灰石样品的纯度是85%.
(3)设100千克这种纯度的石灰石充分煅烧后生成二氧化碳的质量为x.
CaCO3
 CaO+CO2↑
CaO+CO2↑100 44
100kg×85% x

x=37.4kg
所以剩余固体的质量=100kg-37.4kg=62.6kg
答:可得到固体质量为62.6千克.
点评:此题是考查学生对图表的分析能力,并利用分析结果进行计算,关键是把握住完全反应的数据,利用有用的数据进行计算.

练习册系列答案
相关题目
石灰石是工业上的一种重要原料,其主要成分是碳酸钙.小黄为了测定从某矿山采来的石灰石中碳酸钙的质量分数,将样品与稀盐酸放在烧杯中反应进行实验,测定的有关实验数据如下表(石灰石中的杂质不参加反应):
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入的盐酸的质量/g | 50.00 | 50.00 | 50.00 | 50.00 |
| 石灰石样品的质量/g | 5.00 | 10.00 | 15.00 | 20.00 |
| 通过计算,生成的二氧化碳的质量/g | 1.76 | 3.52 | 4.40 | 4.40 |
(1)要计算出生成的二氧化碳的质量,还需要测定反应后烧杯中所有剩余物质的质量,请指出在第三次实验中,测定的烧杯中所有剩余物质的质量为________g;
(2)哪几次实验的反应中反应物有剩余?________;
(3)这种石灰石中碳酸钙的质量分数为________.
石灰石是工业上的一种重要原料,其主要成分是碳酸钙.小黄为了测定从某矿山采来的石灰石中碳酸钙的质量分数,将样品与稀盐酸放在烧杯中反应进行实验,测定的有关实验数据如下表(石灰石中的杂质不参加反应):
(反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O)
(1)要计算出生成的二氧化碳的质量,还需要测定反应后烧杯中所有剩余物质的质量,请指出在第三次实验中,测定的烧杯中所有剩余物质的质量为 g;
(2)哪几次实验的反应中反应物有剩余? ;
(3)这种石灰石中碳酸钙的质量分数为 .
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入的盐酸的质量/g | 50.00 | 50.00 | 50.00 | 50.00 |
| 石灰石样品的质量/g | 5.00 | 10.00 | 15.00 | 20.00 |
| 通过计算,生成的二氧化碳的质量/g | 1.76 | 3.52 | 4.40 | 4.40 |
(1)要计算出生成的二氧化碳的质量,还需要测定反应后烧杯中所有剩余物质的质量,请指出在第三次实验中,测定的烧杯中所有剩余物质的质量为 g;
(2)哪几次实验的反应中反应物有剩余? ;
(3)这种石灰石中碳酸钙的质量分数为 .