题目内容
根据如图所示装置回答问题:
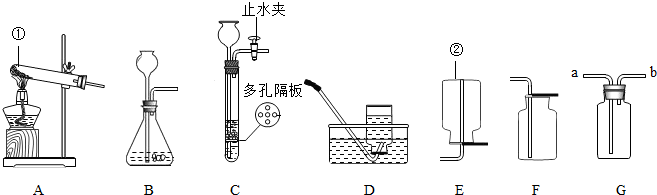
(1)用A装置制取氧气,反应的化学方程式为
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入
(3)制取二氧化碳最好选择的发生装置是
(4)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体.实验室制取H2S气体时,发生装置应选用
(5)红旗水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水.)
有关实验数据如下表:
求该石灰石中碳酸钙的质量分数.

(1)用A装置制取氧气,反应的化学方程式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入
稀盐酸
稀盐酸
.若用G来收集二氧化碳,二氧化碳应从a
a
进(选“a”或“b”).(3)制取二氧化碳最好选择的发生装置是
C
C
(选择“B”或“C”),与另一个装置相比,其优点是:可随时控制反应的发生与停止
可随时控制反应的发生与停止
.(4)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体.实验室制取H2S气体时,发生装置应选用
B或C
B或C
,收集装置应选用F
F
(填仪器编号).(5)红旗水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水.)
有关实验数据如下表:
| 反应前 | 反应后 | ||
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 160g | 12g | 167.6g | |
分析:(1)根据装置的特点分析反应的原理;
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入稀盐酸;
(3)为了控制反应速率,选择C装置;
(4)根据“硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体”,答题:制取气体,选择装置,考虑反应物的状态和反应条件;收集气体的装置,考虑其密度和水溶性;
(5)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;根据化学方程式由二氧化碳的质量可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数.
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入稀盐酸;
(3)为了控制反应速率,选择C装置;
(4)根据“硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体”,答题:制取气体,选择装置,考虑反应物的状态和反应条件;收集气体的装置,考虑其密度和水溶性;
(5)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;根据化学方程式由二氧化碳的质量可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数.
解答:解:(1)用A装置制取氧气,应选用加热高锰酸钾制取氧气,反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑.
故答案为:2KMnO4
K2MnO4+MnO2+O2↑;
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入稀盐酸,若用G来收集二氧化碳,二氧化碳应从a进.
故答案为:稀盐酸;a;
(3)制取二氧化碳最好选择的发生装置是C,与另一个装置相比,其优点是:可以控制反应的开始与结束.
故答案为:C;可随时控制反应的发生与停止;
(4)根据制取气体时,选择装置应考虑反应物的状态和反应条件;收集气体的装置,考虑其密度和水溶性,则实验室制取H2S气体时,属于固液在常温下反应制取气体,发生装置应选用B或C,密度比空气大,能溶于水,收集装置应选用F;
故答案为:B或C;F;
(5)根据质量守恒定律,二氧化碳的质量为:160g+12g-167.6g=4.4g;
设该石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
=
解得x=10g
此石灰石中碳酸钙的质量分数为:
×100%≈83.3%.
答:该石灰石中碳酸钙的质量分数为83.3%.
| ||
故答案为:2KMnO4
| ||
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入稀盐酸,若用G来收集二氧化碳,二氧化碳应从a进.
故答案为:稀盐酸;a;
(3)制取二氧化碳最好选择的发生装置是C,与另一个装置相比,其优点是:可以控制反应的开始与结束.
故答案为:C;可随时控制反应的发生与停止;
(4)根据制取气体时,选择装置应考虑反应物的状态和反应条件;收集气体的装置,考虑其密度和水溶性,则实验室制取H2S气体时,属于固液在常温下反应制取气体,发生装置应选用B或C,密度比空气大,能溶于水,收集装置应选用F;
故答案为:B或C;F;
(5)根据质量守恒定律,二氧化碳的质量为:160g+12g-167.6g=4.4g;
设该石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
解得x=10g
此石灰石中碳酸钙的质量分数为:
| 10g |
| 12g |
答:该石灰石中碳酸钙的质量分数为83.3%.
点评:掌握氧气、二氧化碳的反应原理、实验室制法、化学性质,根据题意,正确书写化学方程式,掌握有关化学方程式的计算和质量分数的计算,难度较小.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目





