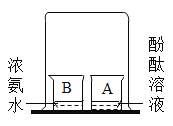
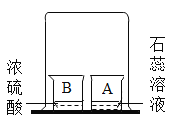
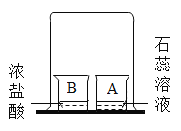
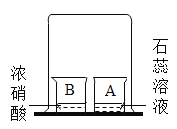
题目内容
【题目】在学生完成“实验活动1氧气的实验室制取与性质”后,吴老师发现部分小组制取氧气后的试管内还有暗紫色固体。吴老师称得某实验小组剩余固体的质量为9.36g,经溶解过滤、洗涤、烘干后所得黑色固体的质量为1.74g。请计算:
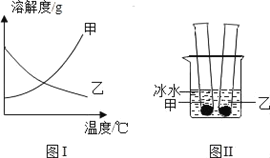
(1)高锰酸钾中锰元素和氧元素的质量比是___。
(2)生成氧气的质量___
(3)该实验小组高锰酸钾的分解率___。
(查阅资料)
(1)含钾元素的化合物都能溶于水
(2)分解率=![]() ×100%
×100%
【答案】高锰酸钾中锰元素和氧元素的质量比是55:64 生成氧气的质量为0.64g 该实验小组高锰酸钾的分解率为63.2%
【解析】
(1)根据高锰酸钾的化学式KMnO4,可以计算中锰元素、氧元素的质量比=55:(16×4)=55:64。
(2)对应物质中只有二氧化锰不溶于水且是黑色固体,所以1.74g为二氧化锰。
设生成的氧气的质量为x,分解的高锰酸钾的质量为y,生成的锰酸钾的质量为z
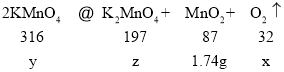
![]()
x=0.64g,y=6.32g,z=3.94g
则没分解的高锰酸钾的质量为9.36g﹣1.74g﹣3.94g=3.68g
则该实验小组高锰酸钾的分解率为![]()
(1)高锰酸钾中锰元素和氧元素的质量比是55:64;
(2)生成氧气的质量为0.64g;
(3)该实验小组高锰酸钾的分解率为63.2%。

【题目】小亮在实验时发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃。那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装入其总容积10%、20%、30%、40%、50%的水。用排水法收集氧气,恰好把5只集气瓶中的水排去。将带火星的木条依次插入①——⑤号瓶中,记录实验现象。
小亮在前一组实验的基础上又做了第二组和第三组实验,三组实验的数据和现象见下表。
第一组 | 第二组 | 第三组 | |||||||||
集气瓶序号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
收集的O2占容积的体积分数(%) | l0 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
带火星木条 的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
请根据实验回答下列问题:
(1)写出实验室用氯酸钾制取氧气的反应化学方程式______________:
(2)当收集的氧气占容积的体积分数最低为______%时,可使带火星的木条复燃,这时集气瓶中氧气的体积分数是___________%(计算结果保留整数)。
(3)根据以上的数据,你认为,使用带火星的木条验满氧气的方法是否可靠:_________ (填“是”或“否”)。
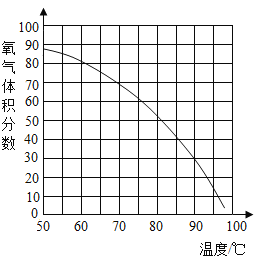
(4)用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸汽所致,此时混合气体中氧气的体积分数随温度变化的曲线如图所示。若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在______℃。
(5)采取“半值法”探究能减少实验次数。
例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%——40%之间,从而省去编号为①、②、⑤的实验。同理,第二组实验可以省去的实验编号为________。